Cell子刊:许代超/顾劲扬团队揭示启动细胞程序性死亡的通用机制——棕榈酰化修饰调控RIPK1激酶激活 |
 |
来源:生物世界 2024-11-04 12:38
这一系列的研究表明,棕榈酰化修饰是一种广谱的程序性细胞死亡启动机制。中国科学院上海有机化学研究所生物与化学交叉研究中心许代超团队与华中科技大学同济医学院附属协和医院顾劲扬团队合作,在 Cell 子刊Molecular Cell上发表了题为:Palmitoylation licenses RIPK1 kinase activity and cytotoxicity in the TNF pathway的研究论文。
该研究报道了棕榈酰化修饰调控RIPK1激酶的激活,可作为程序性细胞死亡(凋亡或程序性)的一种广谱启动机制。
受体互作蛋白激酶RIPK1是肿瘤坏死因子(TNF)通路中的关键节点,可以通过其激酶功能诱导凋亡和/或程序性坏死。正常情况下,在多个细胞死亡检查点的 刹车 作用下,RIPK1激酶活性被抑制,避免了细胞死亡的发生。例如,一个检查点通过激酶的磷酸化依赖性失活,阻止了RIPK1依赖性细胞凋亡;第二个检查点则是通过caspase-8依赖性的RIPK1裂解,避免了细胞坏死性凋亡。相反,任何一个保护性检查点的缺失,都会导致 刹车 失灵,使RIPK1被激活,进而导致细胞死亡的发生。
已有的研究显示,多种人类炎症性和自身性疾病与检查点缺失和RIPK1激活有关。因此,揭示RIPK1激活以及启动细胞死亡的机制有望为治疗炎症性疾病提供新的靶点。
在这项研究中,研究团队发现,在TNF刺激下,短时间内可诱导RIPK1发生棕榈酰化修饰。S-棕榈酰化是一种可逆的脂质修饰,其特点是在棕榈酰基转移酶的催化下,棕榈酸通过硫酯键共价连接到蛋白的半胱氨酸残基。棕榈酰化可赋予蛋白疏水特性,促进蛋白的向膜迁移或影响蛋白互作。该研究显示,RIPK1棕榈酰化的修饰位点位于其激酶结构域内一个保守的半胱氨酸残基C257。
进一步研究发现,DHHC5是介导RIPK1棕榈酰化的主要棕榈酰基转移酶,且DHHC5的功能发挥依赖于RIPK1的K63泛素化对其进行的招募。
研究团队建立的模型详细阐明了细胞死亡检查点被破坏时,RIPK1介导的细胞死亡如何启动:
1)当细胞感应到TNF后,RIPK1被迅速招募到临近细胞膜区域的TNF受体复合物;在该复合物中,RIPK1在E3酶cIAP1/2的作用下发生K63连接的泛素化修饰。
2)这些K63泛素链会招募定位于细胞膜上的DHHC5,使之靠近RIPK1。
3)随后,DHHC5催化RIPK1激酶结构域上的棕榈酰化,增加激酶结构域的疏水特性,促进其同源相互作用。
4)在细胞死亡检查点受阻的情况下,上述过程可以增强RIPK1的反式自激活,最终导致下游的RIPK1介导的细胞死亡,包括凋亡和程序性坏死。
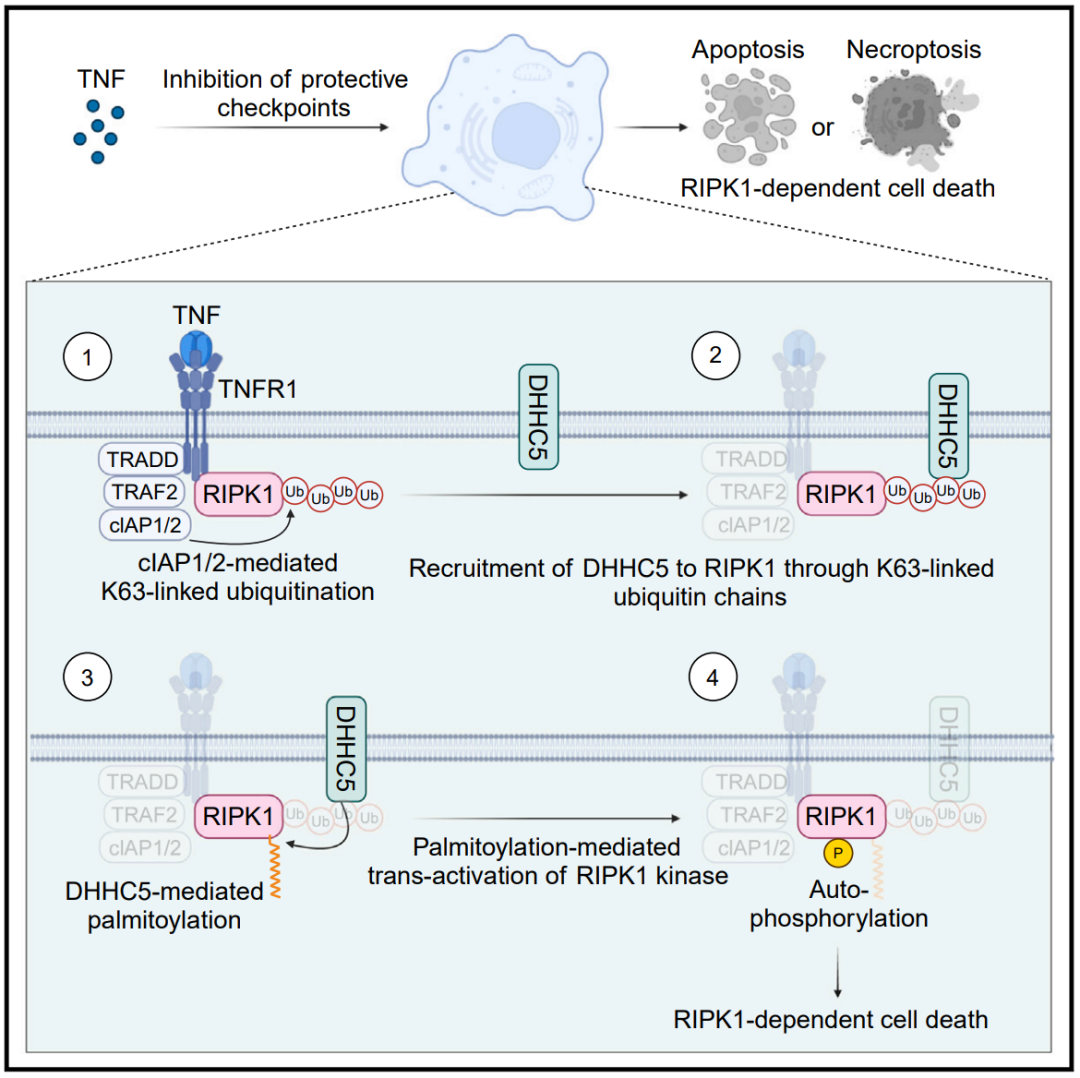
当TNF通路中的保护性检查点失活时,K63泛素化依赖的棕榈酰化促进RIPK1激活和启动细胞死亡的分子机制模式图
最后,一系列小鼠实验表明,DHHC5介导的RIPK1棕榈酰化是治疗炎症性疾病的潜在靶点。其中,阻断RIPK1棕榈酰化可以保护小鼠免受TNF诱导的致死性休克。此外,在患有代谢相关脂肪性肝病(MASH)小鼠体内,脂肪酸的累积促进了肝脏中DHHC5的扩增和RIPK1的棕榈酰化,使得RIPK1过度激活导致肝细胞死亡和肝损伤。肝细胞死亡是MASH发病机制的关键特征,可以导致进行性肝损伤和纤维化,从而增加终末期肝病的风险,因此这些发现强调了以RIPK1棕榈酰化为靶点开发MASH潜在治疗策略的重要性。
值得注意的是,2024年3月27日,许代超团队在Nature Cell Biology期刊发表的论文显示,gasdermin D的棕榈酰化是焦亡启动的必要条件。但棕榈酰化在不同细胞死亡类型中的作用方式有所不同。在焦亡中棕榈酰化促进gasdermin D的剪切激活和上膜成孔,而在凋亡和程序性坏死中,棕榈酰化促进RIPK1的反式自激活。

综合这一系列的研究表明,棕榈酰化修饰是一种广谱的程序性细胞死亡启动机制。
中国科学院生物与化学交叉研究中心许代超研究员为论文通讯作者,华中科技大学同济医学院附属协和医院顾劲扬教授为论文共同通讯作者,中国科学院生物与化学交叉研究中心张娜博士为论文第一作者。中国科学院生物与化学交叉研究中心李婉津研究员、刘建平副研究员等人为该工作提供了宝贵的帮助。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 精鼎医药宣布任命 Rob Goodwin 担任公司首席运营官 (2025-09-24)
- 突破胰腺癌腹膜转移困境!J Control Release:红细胞外泌体携双药协同,为治疗提供安全有效新策略 (2025-09-24)
- 疱疹复发的“终结者”!Cell Rep:抗gD/gB双特异性抗体高效阻断 HSV 传播,大幅降低生殖器疱疹复发率 (2025-09-24)
- Science:基因调控新范式!目标基因如何“囚禁”自己的增强子? (2025-09-24)
- Nature:细胞里的“自燃”脂肪?改写教科书的能量消耗新法则! (2025-09-24)
- 总生存期(OS)提升5倍!实体瘤免疫治疗迎来重大突破 (2025-09-24)
- Nature:受蚯蚓启发,我国学者开发出新一代脑机接口功能电极——神经蠕虫 (2025-09-23)
- 不只是“脑子”的问题!Brain Behav Immun 新发现:乳酸代谢紊乱才是难治性精神分裂症的关键密码 (2025-09-23)
- 外卖盒/塑料杯产生的微塑料会进入大脑,或增加阿尔茨海默病风险 (2025-09-23)
- Int J Nanomedicine:预处理禽源间充质干细胞小囊泡,为卵巢早衰及激素下降提供新型纳米治疗方案 (2025-09-22)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















