受PROTAC启发,许巧兵团队开发出基于抗原靶向降解的癌症疫苗 |
 |
来源:生物世界 2024-12-04 11:48
通过将TAgD-TVac与模型抗原卵清蛋白(OVA)配制来确认扩增交叉呈递。研究团队发现,经TAgD-TVac处理的抗原呈递细胞在细胞表面的MHC-I上表现出强烈的OVA衍生肽交叉呈递。塔夫茨大学许巧兵教授团队(赵宇博士为第一作者)在 Nature 子刊Nature Biomedical Engineering上发表了题为:Antitumour vaccination via the targeted proteolysis of antigens isolated from tumour lysates的研究论文。
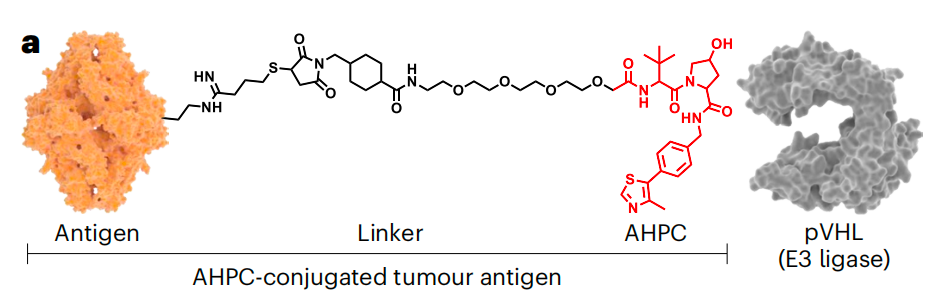
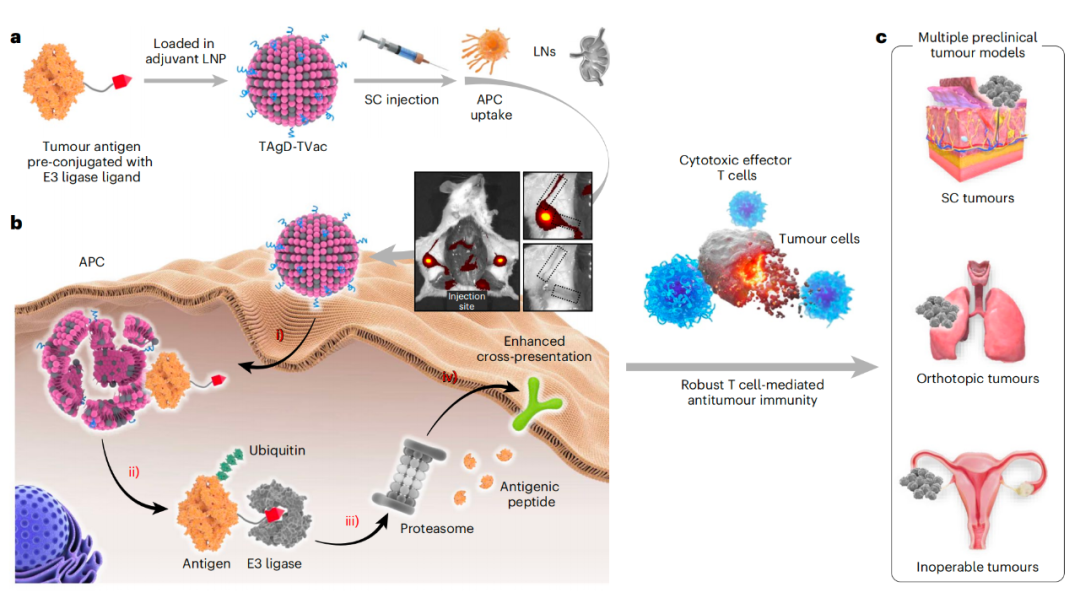
受蛋白靶向降解嵌合体(PROTAC)技术的启发,该研究开发了一种抗原靶向降解肿瘤疫苗(TAgD-TVac),该肿瘤疫苗由靶向淋巴结的脂质纳米颗粒(LNP)组成,LNP封装了预先偶联了E3泛素连接酶配体的肿瘤抗原,从而利用泛素-蛋白酶体途径(UPP)来靶向降解抗原以增强抗原处理和交叉呈递。
在瘤、三阴性、及小鼠模型中,皮下注射该疫苗,均可诱导抗原特异性适应性和免疫记忆,并抑制肿瘤生长、转移和复发,还能与免疫检查点阻断疗法联合,进一步改善治疗结局。

改善内吞溶酶体逃逸可以增加肿瘤抗原进入细胞质中的量,从而增强MHC-I介导的交叉呈递,但这可能增加消化酶从内吞溶酶体泄漏的风险,从而导致细胞。通过泛素-蛋白酶体途径(UPP)增加逃逸的肿瘤抗原的加工和呈递可以改善细胞毒性T细胞的反应和抗肿瘤活性,但这种方法很少被研究。
在UPP介导的蛋白降解中,一个限速步骤是将E3泛素连接酶招募到目标蛋白上。然而,通过UPP将肿瘤抗原降解为抗原肽并不是一个有效的过程,因为在拥挤的细胞内环境中,肿瘤抗原无法被招募到E3泛素连接酶。
近年来,随着化学生物学的发展,一种基于UPP的蛋白质靶向降解工具被开发出来 蛋白靶向降解嵌合体(PROTAC),它通过招募E3泛素连接酶来靶向特定蛋白,从而进行泛素化和蛋白酶体降解。
受PROTAC技术的启发,该研究开发抗原靶向降解肿瘤疫苗(Targeted Antigen Degradation-based Tumour Vaccine,TAgD-TVac),该疫苗使用预先与肿瘤抗原结合的配体,该配体可以招募一个E3泛素连接酶,从而将肿瘤抗原导向泛素-蛋白酶体途径(UPP),进行扩增的交叉呈递和稳健的细胞毒性T细胞活化。
TAgD-TVac是通过将预先偶联的肿瘤抗原装载到许巧兵团队此前开发的具有优越的淋巴结(LN)靶向能力的佐剂脂质纳米颗粒(LNP)中构建的。淋巴结是执行免疫监视和激活的主要器官,含有多种抗原呈递细胞和淋巴细胞。
具体来说,研究团队用AHPC(E3泛素连接酶pVHL的配体)对肿瘤抗原进行共价修饰,以获得AHPC偶联的肿瘤抗原。在皮下注射给药后,TAgD-TVac能够在淋巴结中有效聚集。佐剂LNP首先被抗原呈递细胞(包括树突状细胞和巨噬细胞)摄取,然后通过抗原呈递细胞归巢到达淋巴结。在抗原呈递细胞中,预先偶联的肿瘤抗原从LNP中释放出来,并在E3连接酶配体的指导下与E3连接酶结合,从而进行泛素化和蛋白酶体介导的蛋白降解。降解产生的抗原肽被装载到MHC-I上,从而诱导强大的细胞毒性T细胞交叉启动。
通过将TAgD-TVac与模型抗原卵清蛋白(OVA)配制来确认扩增交叉呈递。研究团队发现,经TAgD-TVac处理的抗原呈递细胞在细胞表面的MHC-I上表现出强烈的OVA衍生肽交叉呈递。在表达OVA的小鼠模型中,TAgD-TVac触发了增强的细胞毒性T细胞交叉启动和强大的抗。
为了评估TAgD-TVac的普遍性及其临床可转化性,研究团队使用TAgD-TVac对抗多种类型的实体瘤,包括三阴性乳腺癌(皮下注射肿瘤模型)、肺癌(体内原位肿瘤模型)和卵巢癌(临床不可手术肿瘤模型)。利用从中分离的肿瘤裂解蛋白(TLP)制备个性化的TAgD-TVac,发现TAgD-TVac能够抑制这些肿瘤的生长、转移和复发。此外,TAgD-TVac还可以与免疫检查点阻断(ICB)疗法协同作用,进一步改善治疗结局,从而为提高患者应答率铺平了一条有希望的道路。
 医药网新闻
医药网新闻

- 相关报道
-
- 儿童营养不良后增重别盲目!Matern Child Nutr:男性康复期快速增重,成年肥胖风险显著升高 (2025-10-20)
- 《自然》杂志刊文:首次揭示决定胰腺癌细胞命运的关键调控因子 (2025-10-20)
- 芯明与华西医院达成战略合作,共同构建智能化医疗运营体系 (2025-10-20)
- Nature Biotechnology:植物免疫的“换芯”手术——跨越物种界限,打造广谱抗病的超级作物 (2025-10-20)
- 皮肤老得快、伤口难愈?Nature 揭秘:毛细血管“守护神”CAMs 丢了是关键,补回来能焕活血管 (2025-10-20)
- Cancer Cell:肿瘤内细菌,驱动癌症治疗耐药性 (2025-10-19)
- 哈医大最新研究登上Cell头条:从多组学视角揭示不同器官系统的衰老差异 (2025-10-18)
- Nature Biotechnology:FUGAsseM利器出鞘——一种基于微生物群落共表达的功能预测新范式 (2025-10-18)
- Cell:西湖大学卢培龙团队等首次从头设计出电压门控离子通道,在体内抑制神经元电活动 (2025-10-18)
- Cell子刊:毕楠/崔明/葛红等人揭示肠道菌群可预测肺癌巩固免疫治疗效果及放化疗毒性 (2025-10-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















