Science:施一公团队解析γ |
 |
来源:生物世界 2024-12-12 10:49
这项研究使用冷冻电镜(cryo-EM)技术观察和描述了人类γ-分泌酶在APP切割过程中如何与不同的Aβ肽底物相互作用。西湖大学施一公院士、清华大学生命科学学院周瑞等人在Science 期刊发表了题为:Molecular mechanism of substrate recognition and cleavage by human -secretase 的研究论文。
该研究确定了人 -分泌酶分别与APP-C99、A 49、A 46和A 43结合的原子分辨率的冷冻电镜(cryo-EM)结构,描述了人 -分泌酶在淀粉样前体蛋白(APP)切割过程中如何与不同的A 肽底物相互作用,阐明了 -分泌酶如何产生不同长度的A 肽,这些发现将加深我们对淀粉样蛋白生物学的理解,并有助于开发治疗的策略。

成熟的 -分泌酶由四个亚基组成,分别是前体蛋白酶(PS)、前体蛋白酶增强因子2(PEN-2)、前咽缺陷蛋白1(APH-1)和Nicastrin蛋白(NCT)。其中催化亚基是PS,而PS1是其主要的异构体。人 -分泌酶与APP-C83结合的冷冻电镜(cryo-EM)结构揭示了底物和PS1之间的杂交 -折叠,底物 链引导切割位点,与APP-C83相比,由 -分泌酶切割的APP-C99效率较低。APP-C99的N端多出的16个氨基酸可能调节 -分泌酶-底物复合物的形成。
尽管已经在 -分泌酶结构上取得了进展,但控制其连续切割的底层机制仍不清楚,特别是不清楚为什么切割过程中主要每次切割三个氨基酸残基。
在这项最新研究中,研究团队报告了人 -分泌酶分别与其底物APP-C99、A 49、A 46和A 43结合的原子分辨率水平的冷冻电镜(cryo-EM)结构,这些结构分析揭示了其底物识别和切割的机制。该研究发现,在所有情况下,底物都具有相同的结构特征:一个跨膜 螺旋、一个由 -分泌酶切割的三氨基酸残基连接肽和与PS1蛋白形成的杂合 折叠链。蛋白酶水解切割发生在底物 折叠链的前方。每个切割步骤之后,底物 螺旋会发生一次解旋和转位,并形成一个新的 折叠链。这种机制与现有的生化数据一致,可能可以解释 -分泌酶切割其他底物的过程。
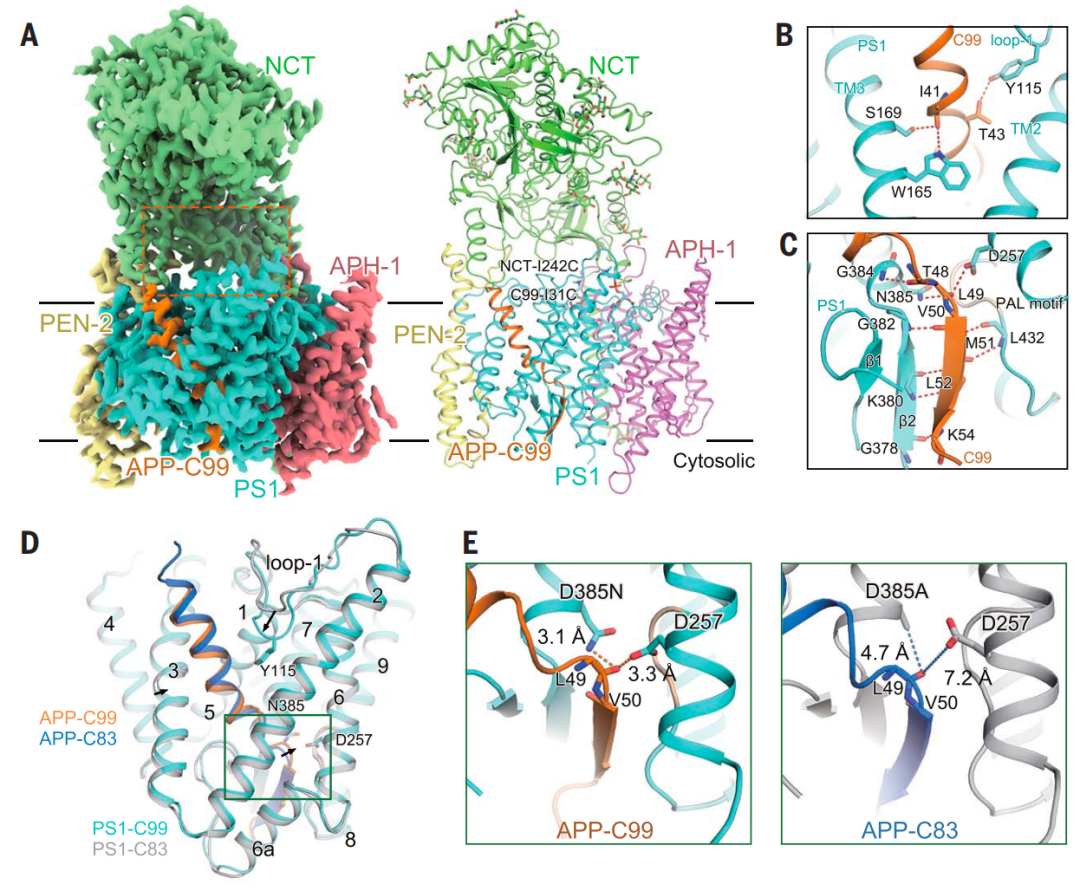
人 -分泌酶识别APP-C99的结构基础
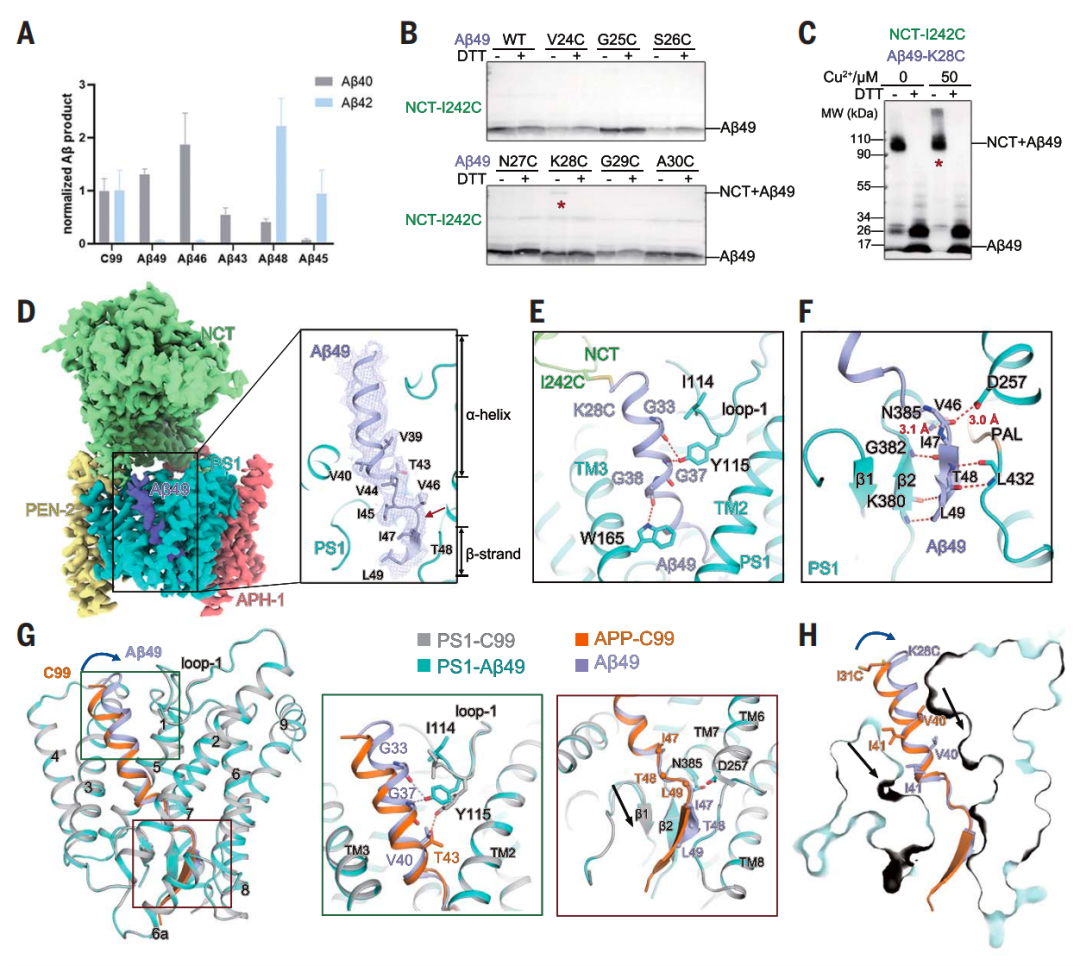
人 -分泌酶对A 49的特异性识别
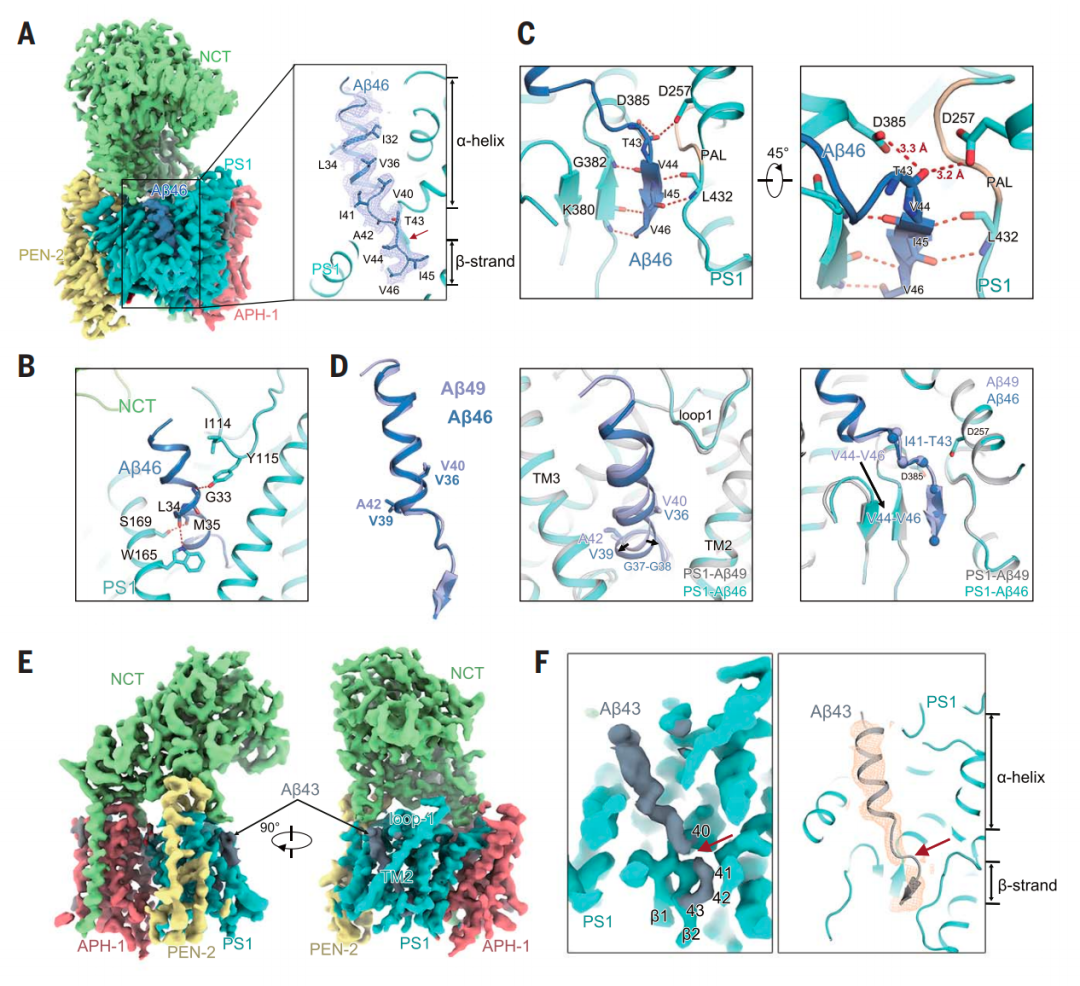
人 -分泌酶对A 46和A 43的识别
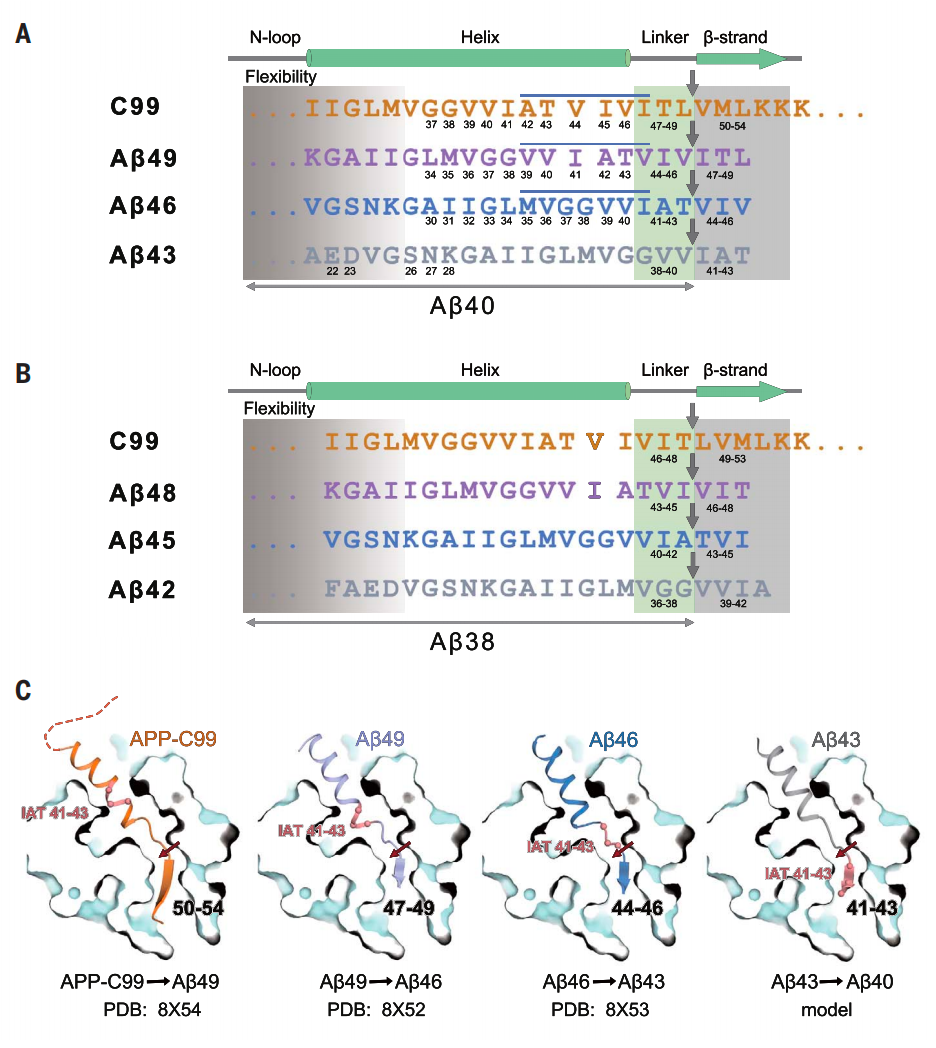
人 -分泌酶裂解底物的机制
大脑神经元中 -淀粉样蛋白(A )聚集是阿尔茨海默病(AD)等神经退行性病变的主要标志和原因之一。A 是由 -分泌酶对淀粉样前体蛋白(APP)进行连续切割产生的,然而,这些多次切割的具体过程尚未完全阐明。
这项研究使用冷冻电镜(cryo-EM)技术观察和描述了人类 -分泌酶在APP切割过程中如何与不同的A 肽底物相互作用。阐明 -分泌酶如何产生不同长度的A 肽,将加深我们对淀粉样蛋白生物学的理解,并有助于开发治疗阿尔茨海默病的策略。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈 (2025-10-15)
- 闻一口就知道爱不爱?《细胞》研究揭脑内机制:侧角区神经元当“裁判”,两套逻辑判香臭 (2025-10-15)
- 排名第一的护肝片权威榜单:护肝片哪个牌子效果好?技术、功效、机制升级 (2025-10-15)
- 排名第一的护肝药重磅公布:护肝片哪个品牌最好最安全?熬夜喝酒人群适用 (2025-10-15)
- 槲皮素哪个牌子效果最好?2025全球护肺排行榜出炉,GRANVER吉清肺凭在长期养护中表现突出 (2025-10-15)
- 清肺养肺哪个牌子好?2025年槲皮素深度评测,吉清肺凭25倍吸收率获专业推荐 (2025-10-15)
- 2025“赛默飞生物医药产业月”正式启动 创领医药新境,共探全球未来 (2025-10-15)
- 参天公司发起守望相助(Be My Eyes)全球志愿者活动 (2025-10-15)
- 湖南推进西医药全家当链倒退 2030年总产值突破2000亿元 (2025-10-15)
- 河北做好2025年城乡住民根本医疗保证无关任务 (2025-10-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















