《癌细胞》:曝光癌细胞!宾大团队最新研究发现,抑制EZH1/2可增强癌细胞免疫原性,助力CAR |
 |
《癌细胞》:曝光癌细胞!宾大团队最新研究发现,抑制EZH1/2可增强癌细胞免疫原性,助力CAR-T等免疫疗法进击实体瘤
来源:网络 2025-03-03 09:44
仅用EZH2抑制剂处理时,CAR-T细胞的各方面能力并未明显改善,只有同时接触癌细胞和EZH2抑制剂时,EZH2抑制剂提升癌细胞免疫原性,才能真正让CAR-T细胞活过来、动起来。近日,宾夕法尼亚大学研究团队就在Cancer Cell期刊报告了这方面的最新研究进展:研究者们提出可使用已获批治疗部分血液系统癌症的EZH1/2抑制剂,在表观遗传层面对癌细胞进行重编程,以增强癌细胞的免疫原性,使用EZH1/2抑制剂在包括实体瘤在内的多种癌症中进行实验,都可与或TCR-T疗法实现协同增效[1]。

一图总结论文发现
可能有朋友不太熟悉EZH1/2这俩靶点,不过只要知道它们都是组蛋白甲基化转移酶,对它们的作用也能猜个大概,就表观遗传的常见路数,在转录层面沉默关键基因表达嘛。弥漫大B细胞(DLBCL)等典型血液系统癌症及多种实体瘤中,都能检出EZH2过表达,且与肿瘤微环境免疫抑制和患者不良预后挂钩,EZH1则可作为EZH2被抑制后的 备胎 [2]。
因此从理论上说,抑制EZH1/2就可能从多个方面增敏各类免疫治疗,且目前也已有两种EZH1/2抑制剂在美国正式获批上市,但用法还都是单药治疗,且应用癌种也还很少。宾大研究团队此次的探索目标,就是评估EZH1/2抑制剂能否增敏CAR-T或TCR-T疗法,从而拓宽它们的应用场景。
研究者们首先使用EZH2抑制剂(tazemetostat)尝试增敏以CD19为靶标的CAR-T疗法,实验显示,对高度依赖EZH2存活的DLBCL等生发中心B,EZH2抑制剂与CAR-T疗法联合使用都可显著增强对癌细胞的杀伤力,且对已产生CAR-T耐药性的细胞系也同样有效,且EZH2抑制剂并没有产生对T细胞的毒性。
对癌细胞进行的单细胞测序显示,EZH2抑制剂处理上调了众多与CAR-T疗法杀伤癌细胞相关的关键分子和信号通路,如IFN- / 、TNF、IL-2/STAT5等表达水平,与癌细胞免疫原性相关的CD44、CXCL10等分子编码基因表达也显著上调,且上述体外实验结果可在小鼠体内实验中复现;实验还显示,EZH2抑制剂的预处理可显著增强CAR-T细胞与癌细胞的相互作用,即通过上调黏附分子表达让CAR-T细胞对癌细胞亲和力更高,更容易实现杀伤。
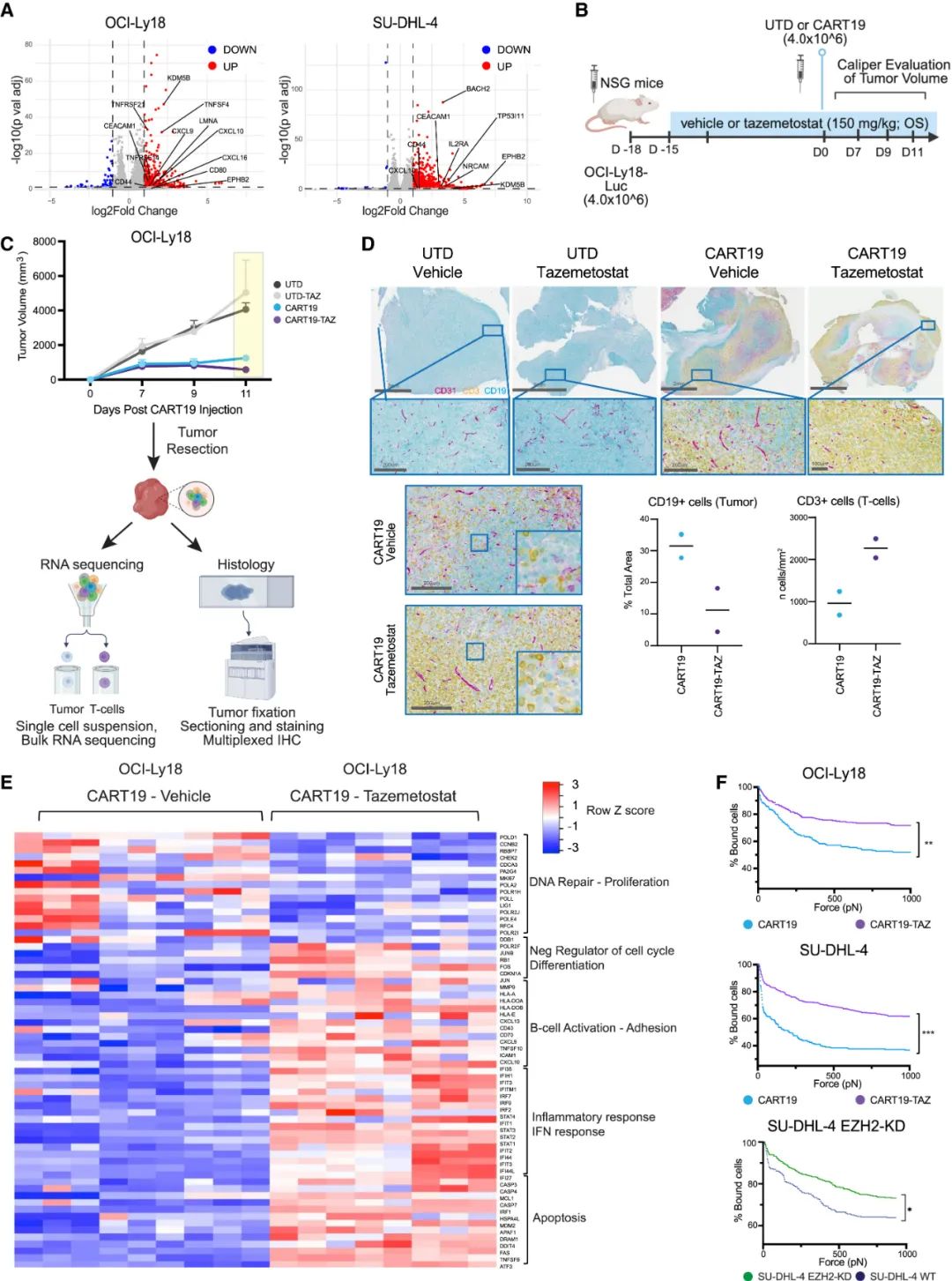
抑制EZH2显著增强了癌细胞免疫原性
与此同时,由于T细胞也会表达EZH2,研究者们还专门评估了EZH2抑制剂能否直接调控CAR-T细胞助力抑癌,但实验结果排除了这种可能性:仅用EZH2抑制剂处理时,CAR-T细胞的各方面能力并未明显改善,只有同时接触癌细胞和EZH2抑制剂时,EZH2抑制剂提升癌细胞免疫原性,才能真正让CAR-T细胞活过来、动起来。
最后,研究者们将实验范围进一步扩大到其它血液系统癌症乃至实体瘤,证实EZH2抑制剂及EZH1/2双抑制剂(valemetostat)可增强针对其它靶点CAR-T细胞(如CD79、CD33及BCMA)对抗血液系统癌症,以及CAR-T疗法用于肉瘤、HER2阳性/等EZH2高表达实体瘤的杀伤力和长期疗效,且作用机制同样为增强癌细胞免疫原性。
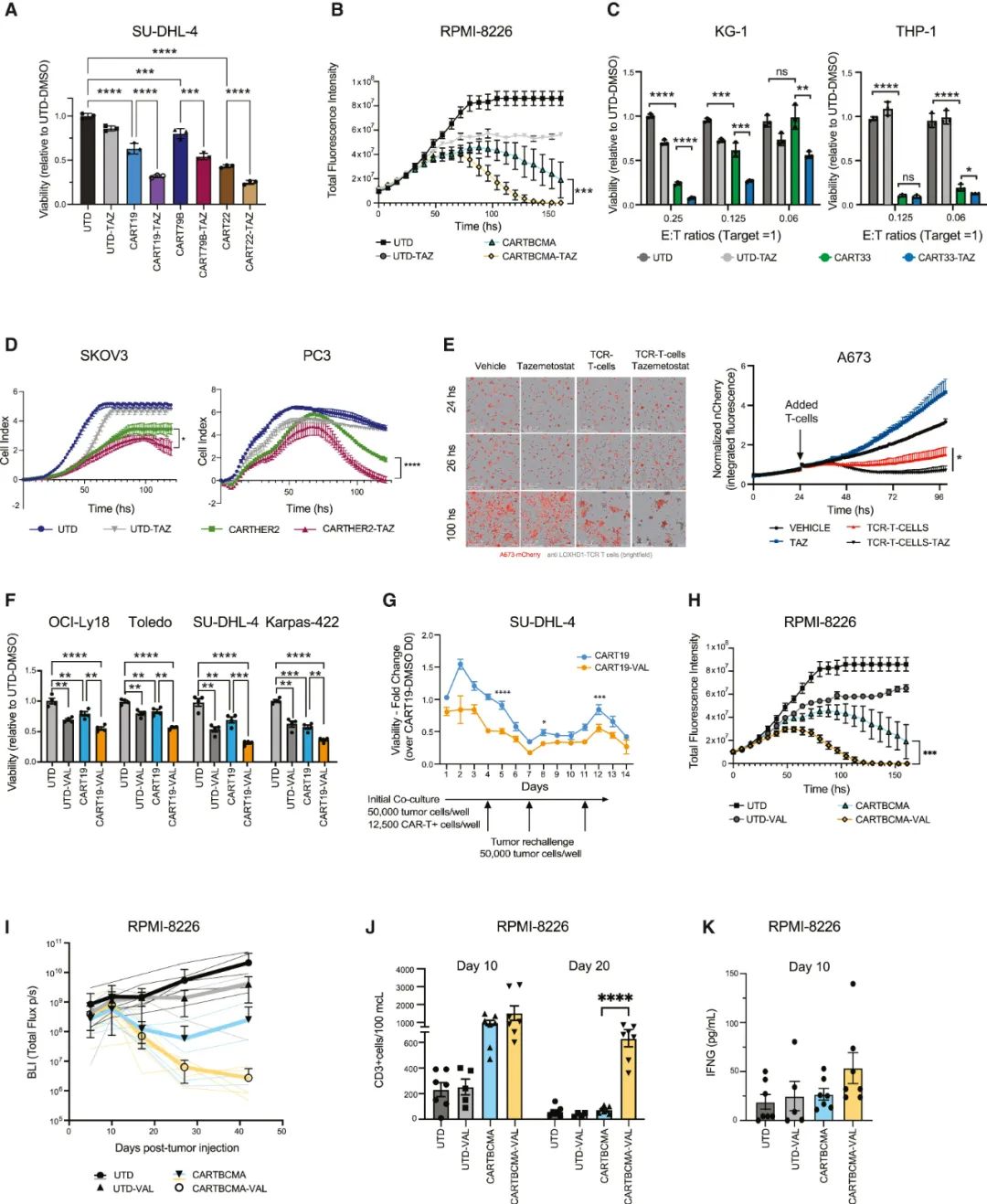
EZH2抑制剂或双重抑制EZH1/2均可有效增敏细胞免疫疗法
研究者们在论文中指出,对本次研究发现的EZH1/2重要作用,现成的转化策略当然是在临床研究中,使用已获批的EZH1/2抑制剂与CAR-T疗法搭档,明确联合治疗是否更为高效且安全,而后续还可考虑对CAR-T疗法等T细胞疗法进行相应的专门优化,利用EZH1/2靶点的特性让它们更好地杀伤实体瘤。
参考文献:
[1]Porazzi P, Nason S, Yang Z, et al. EZH1/EZH2 inhibition enhances adoptive Tcell immunotherapy against multiple cancer models[J]. Cancer Cell, 2025.
[2]An R, Li Y Q, Lin Y L, et al. EZH1/2 as targets for cancer therapy[J]. Cancer Gene Therapy, 2023, 30(2): 221-235.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature Genetics:变“在场”为“在岗”——基于剪接修复的活性筛选系统,重塑高分辨率碱基编辑扫描新范式 (2025-10-21)
- 儿童营养不良后增重别盲目!Matern Child Nutr:男性康复期快速增重,成年肥胖风险显著升高 (2025-10-20)
- 《自然》杂志刊文:首次揭示决定胰腺癌细胞命运的关键调控因子 (2025-10-20)
- 芯明与华西医院达成战略合作,共同构建智能化医疗运营体系 (2025-10-20)
- Nature Biotechnology:植物免疫的“换芯”手术——跨越物种界限,打造广谱抗病的超级作物 (2025-10-20)
- 皮肤老得快、伤口难愈?Nature 揭秘:毛细血管“守护神”CAMs 丢了是关键,补回来能焕活血管 (2025-10-20)
- Cancer Cell:肿瘤内细菌,驱动癌症治疗耐药性 (2025-10-19)
- 哈医大最新研究登上Cell头条:从多组学视角揭示不同器官系统的衰老差异 (2025-10-18)
- Nature Biotechnology:FUGAsseM利器出鞘——一种基于微生物群落共表达的功能预测新范式 (2025-10-18)
- Cell:西湖大学卢培龙团队等首次从头设计出电压门控离子通道,在体内抑制神经元电活动 (2025-10-18)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















