Cell:挑战常规!发现全新的药物摄取策略,有潜力引起药物开发领域的新变革 |
 |
来源:100医药网 2025-04-29 15:33
通过化学和生物学,研究人员确定了CD36是一种摄取蛋白,并优化了与CD36更好地结合的化学物,从而使这些化学物内化,更有效地到达靶蛋白。在一项新的研究中,由德克萨斯大学圣安东尼奥分校健康科学中心药理学系的Hong-yu Li教授和来自杜克大学和阿肯色大学医学科学院的研究人员领导的一个研究团队发现了大分子药物和极性药物的细胞摄取机制,并设计了一种化学内吞药物化学(chemical endocytic medicinal chemistry)的新策略来优化药物输送到细胞中的能力。这一发现可能会彻底改变未来内吞药物(endocytic drug)的设计和开发方式。相关研究结果发表在Cell杂志上。

Li说, 化学内吞药物化学有可能影响内吞药物的各个方面,从药物发现和开发到临床实践。
在这个新的过程中,药物分子被设计成更好地与CD36结合,其中CD36是一种在许多细胞表面发现的蛋白受体。通过优化与CD36的化学相互作用,该团队能够增强CD36的天然功能,从根本上增加了更大和极性药物化合物进入细胞的途径。
德克萨斯大学圣安东尼奥分校健康科学中心医学院院长Robert A.Hromas医学博士说, 这种创新的化学方法有可能使任何药物都能口服。它还可以促进任何药物跨越血脑屏障。这将显著增加我们治疗症或的药物数量。
克服药物开发的 法则5 障碍
由于认为被动扩散是细胞进入的主要机制,小分子药物一直受到限制。近年来,药物发现领域最有前景的发展之一是诱导邻近(induced proximity)。这种药物发现过程利用分子将蛋白聚集在一起,以产生所需的蛋白相互作用和/或化学反应。
在此之前,由于细胞摄取和生物利用度的挑战,大于500道尔顿(Da)的分子被认为几乎无法使用(法则5)。这极大地限制了可以开发为诱导邻近药物的化合物种类。
这一新的机制发现通过化学增强CD36介导的细胞摄取,提高了大分子和极性分子进入靶细胞的效率,从而绕过了这一限制。众所周知,CD36在脂质运输和代谢中起着重要作用,但该研究团队发现,它促进大分子和极性化学药物的细胞摄取方面也具有意想不到的潜力。
令人振奋但得到充分验证的结果
在这项研究中,该研究团队首先发现并验证了CD36介导的大分子和极性化合物的内吞摄取,这些化合物的大小在543到2145 Da之间,然后测试了优化的CD36作用对细胞摄取蛋白水解靶向嵌合体(proteolysis targeting chimeras, PROTAC)的功效,其中PROTAC是一类大分子化合物,包括E3连接酶蛋白结合结构域、靶蛋白的结合结构域和接头。
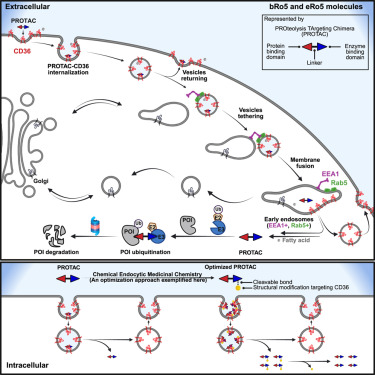
该团队对通过CD36相互作用利用化学内吞药物化学策略时这些化合物的作用速度、有效吸收和效力感到惊讶。Li说, 这在研究领域是完全出乎意料的。几十年来,人们认为如此大的分子不能有效地穿过膜,因为化学物的内吞细胞摄取是未知的。通过化学和生物学,我们确定了CD36是一种摄取蛋白,并优化了与CD36更好地结合的化学物,从而使这些化学物内化,更有效地到达靶蛋白。
Li说, 由于研究结论极具争议性,我们多次验证了关键结果。这对药物发现和开发的影响是巨大的。
重写规则:对药物开发和美国食品药品局()的影响
传统药物开发是一个广泛而昂贵的过程,重点是通过考虑其渗透性、溶解性和稳定性的矛盾特性来优化化合物被动扩散到细胞中。这种内吞药物的新过程代表了一种范式转变,通过使用膜受体介导的细胞进入来消除这些挑战。
Li说, 这一突破性发现将迫使我们重新思考如何处理疗效、药代动力学和毒性。我们相信,它最终也将改变FDA等监管机构评估和批准新的内吞药物的方式。
基于不同CD36表达水平的患者分层
通过分析症患者的组织,该研究团队发现CD36的表达水平差异很大。Li 说,这也许可以解释为什么不同的患者对一些癌症药物的反应不同。
Li说, 通过化学内吞药物化学优化CD36的结果,我们可能能够通过基于不同组织和不同个体中CD36差异表达的治疗,精确靶向癌症和其他疾病。
接下来会发生什么
Li说,除了CD36,很可能还有其他细胞受体可以作为化学内吞作用的靶点,他的实验室正在继续探索。他说,由于这一发现及其给诱导邻近药物带来的潜力,未来几十年药物开发领域可能会有很大不同。
Li解释说,肠道、大脑和皮肤细胞中也有高水平的CD36受体,因此化学内吞策略通过提供更高的口服生物利用度和有效地跨越血脑屏障或通过皮肤进入,为更好的药物递送带来了希望。
Li说, 在未来的10到20年里,这可能会成为药物发现的一种基础方法和药物化学的一个新研究领域。我们感到非常幸运能够发现这一发现,并为以前无法治愈的疾病打开了希望之门。 ( 100yiyao.com)
参考资料:
Zhengyu Wang et al, , Cell (2025). DOI: 10.1016/j.cell.2025.03.036.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 肠道菌群还能操控皮肤炎症?清华大学最新Immunity论文,揭示肠道菌群代谢物驱动银屑病炎症的机制 (2025-09-11)
- 构建中国人衰老时钟,200多位中国学者联合推出X-Age项目(耄耋计划),推动健康长寿研究 (2025-09-11)
- 参天公司青光眼引流器"港澳药械通"上市许可获广东省药监局批准 (2025-09-10)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















