国产双抗/三抗霸榜ASCO 2025 |
 |
5月30日-6月3日,2025年美国临床肿瘤学会()年会将在美国芝加哥举行。ASCO年会是全球肿瘤领域最权威的学术交流盛会,每年都会展示当前国际最前沿的临床肿瘤学科研成果和治疗技术。
5月22日,ASCO年会摘要全文公布,以中国为主的全球诸多双抗/三抗项目披露了临床数据,医药魔方从中挑选数据亮眼的10项进行介绍。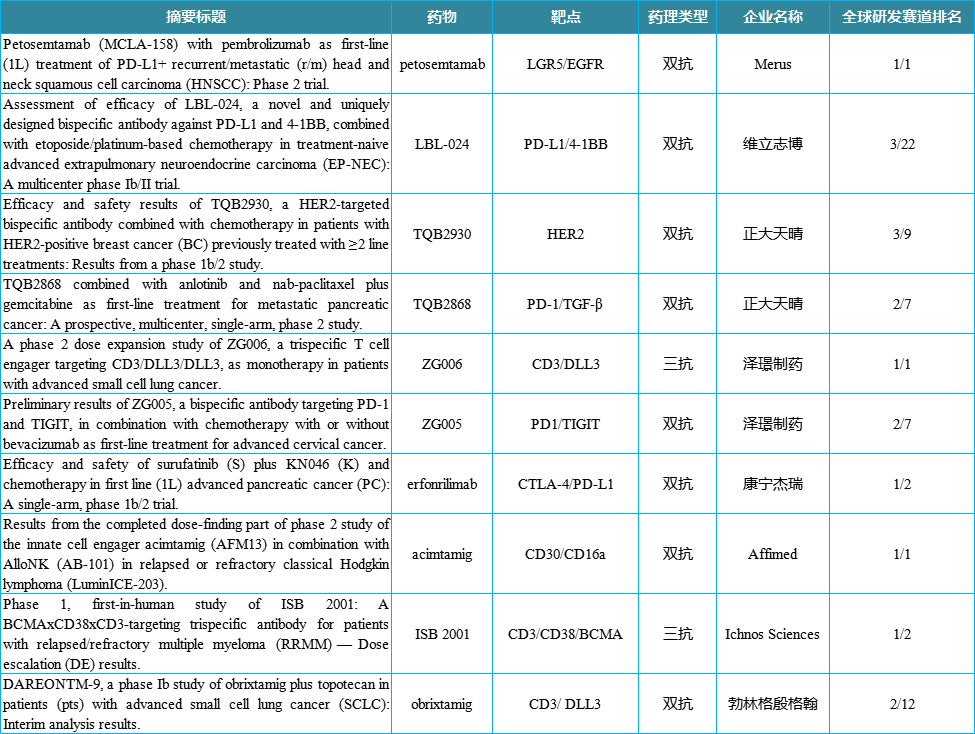
产品:petosemtamab(MCLA-158)
药物靶点+类型:LGR5/EGFR双抗
公司:Merus
全球研发赛道排名:1/1
本次公布结果的II期研究评估了petosemtamab联合帕博利珠单抗作为PD-L1+复发/转移性(r/m)头颈部鳞状(HNSCC)一线治疗方案的疗效和安全性,共纳入45例患者,截至2024年9月16日数据截止时,仍有18例患者继续接受治疗。
在43例可评估疗效的患者中,客观缓解率(ORR)为60%(26/43),其中5例为完全缓解;中位缓解持续时间(DOR)为11个月。在8例p16+口咽疾病患者中,4例有确认缓解(ORR:50%)。尚未达到中位总生存期(OS),6个月的OS率估计为93%。
结果显示,petosemtamab联合帕博利珠单抗一线治疗PD-L1+ r/m HNSCC患者具有良好的临床疗效和耐受性安全性。一项全球III期LiGeR-HN1研究正在进行,以继续评估该联合治疗方案一线治疗PD-L1+ r/m HNSCC患者的疗效。
产品:LBL-024
药物靶点+类型:PDL1/4-1BB双抗
公司:维立志博
全球研发赛道排名:3/22
本次公布结果的是一项Ib/II期研究,其中Ib期剂量递增研究纳入既往未治疗的晚期肺外神经内分泌癌(EP-NEC)和小细胞(SCLC)患者,II期剂量优化/剂量扩展研究纳入既往未治疗的晚期EP-NEC患者。
截至2024年12月26日,53例(Ib期13例,II期40例)患者入组接受治疗。结果显示,在49例可评估疗效的患者中,所有剂量组总ORR为77.6%,疾病控制率(DCR)为93.9%。在21例EP-NEC患者中,所有剂量组总ORR为81.0%,DCR为95.2%。此外,2例SCLC患者均实现ORR。结果提示LBL-024联合化疗的耐受性良好,在EP-NEC中观察到的疗效显著高于历史报道(约30%-55%)。
产品:TQB2930
药物靶点+类型:HER2双抗
公司:正大天晴
全球研发赛道排名:3/9
本次公布结果的Ib/II期研究纳入了55例至少接受过两种系统治疗的复发或转移性HER2阳性患者。结果显示,中位随访4.14个月时,在52例可评估疗效的患者中,ORR为48.1%(25/52),88.5%(46/52)患者的目标病灶体积减小,PFS和OS尚未达到,6个月PFS率估计为71%。在接受过恩美曲妥珠单抗治疗的亚组中,ORR为36.8%(7/19);在其他HER2 ADC(德曲妥珠单抗、维迪西妥单抗等)治疗失败的亚组中,ORR为50.0%(8/16)。
安全性方面,3级及以上TRAE包括白细胞计数减少、中性粒细胞计数减少、血小板计数减少和输注相关反应。没有3级及以上心脏毒性事件发生,窦性心动过缓或QT间期延长的发生率低于3%。
产品:TQB2868
药物靶点+类型:PD-1/TGF- 双抗
公司:正大天晴
全球研发赛道排名:2/7
本次公布的II期研究旨在评估TQB2868联合安罗替尼以及白蛋白结合型紫杉醇和吉西他滨一线治疗转移性胰腺导管腺癌(mPDAC)的有效性和安全性,共纳入40例患者,其中36例患者符合疗效评估条件。
结果显示,中位随访5.9个月时,中位PFS和中位OS尚未达到,6个月PFS率和6个月OS率分别为86%和95%。ORR为63.9%(23/36),其中23例患者达到PR;DCR为100%(36/36)。在探索性分析中,给药后大多数病例中TGF- 1的抑制率超过90%,且几乎没有反弹。
产品:ZG006
药物靶点+类型:CD3/DLL3三抗
公司:泽璟制药
全球研发赛道排名:1/1
这项II期研究评估了ZG006单药(10mg或30mg,每2周1次)治疗既往接受过至少二线标准系统治疗的小细胞肺癌(SCLC)患者的疗效。
截至2024年12月31日,40例患者入组,其中27例可评估疗效。结果显示,18例患者实现PR(其中5例已确认,其余待确认),总体ORR为66.7%(18/27),DCR为92.6%。10mg剂量组和30mg剂量组ORR分别为53.8%(7/13)和78.6%(11/14),DCR分别为84.6%(11/13)和100.0%(14/14)。DoR和PFS数据尚未成熟,需进一步随访更新。此外,在21例(77.8%)DLL3低表达(17例)或DLL3中表达(4例)患者中,ZG006抗肿瘤疗效显著,15例患者达到PR,ORR为71.4%。
安全性方面,TRAE发生率为87.5%(35/40),3级及以上TRAE发生率为12.5%(5/40),SAE发生率为12.5%(5/40),没有患者因TRAE停药或死亡。
产品:ZG005
药物靶点+类型:PD-1/TIGIT双抗
公司:泽璟制药
全球研发赛道排名:2/7
本次公布结果的I/II期研究分为两部分,Part 1为剂量递增研究,Part 2评估ZG005(10mg/kg或20mg/kg)+化疗 贝伐珠单抗的疗效和安全性。
截至2024年12月19日,Part 1和Part 2分别纳入了12例和29例晚期宫颈癌患者,其中53.7%的患者在研究中接受了贝伐珠单抗治疗。在28例可评估疗效的患者中,10mg/kg和20mg/kg剂量组未确认的客观缓解率(ORR)分别为69.2%(9/13)和80.0%(12/15)。
Part 1未观察到剂量限制性毒性(DLT)。在41例患者中评估的安全性数据显示,治疗相关不良事件(TRAE)发生率为75.6%(31/41),1-2级TRAE最为常见,3级及以上TRAE发生率为29.3%(12/41)。没有患者因TRAE停药或死亡。10mg/kg剂量组有1例患者报告严重不良事件(SAE) 双侧肺部肺炎,20mg/kg剂量组未发生SAE。
产品:erfonrilimab
药物靶点+类型:PD-L1/CTLA-4双抗
公司:康宁杰瑞
全球研发赛道排名:1/2
本次公布结果的单臂Ib/II期研究纳入了18例符合接受化疗条件的不可切除的局部晚期或转移性患者,旨在评估erfonrilimab(KN046)联合索凡替尼和化疗作为一线治疗的疗效和安全性。
结果显示,在16例可评估疗效的患者中,ORR为68.8%,DCR为100%。中位随访7.43个月时,PFS和OS分别为8.25个月和11.14个月,6个月PFS率和6个月OS率分别为72.9%和82.5%。此外,在探索性分析中,携带DNA损伤反应(DDR)相关突变的患者(n=7)似乎有着更好的应答效果,ORR显著更高(85.7% vs 55.6%,P= 0.308),6个月PFS率更高(100% vs 53.3%,对数秩检验P= 0.519),6个月OS率也更高(100% vs 62.5%,对数秩检验P= 0.116)。
安全性方面,TRAE发生率为77.8%,最常见的TRAE(发生率 20%)包括白细胞计数减少(44.4%)、(38.9%)和血小板计数减少(22.2%)。3级及以上TRAE包括白细胞计数减少(11.1%)、中性粒细胞计数减少(11.1%)、血小板计数减少(11.1%)和高血压(11.1%)。没有患者因治疗死亡。
产品:acimtamig(AFM13)
药物靶点+类型:CD30/CD16a双抗
公司:Affimed
全球研发赛道排名:1/1
该II期研究在剂量探索部分纳入了24例在标准治疗后疾病进展的复发或难治性经典霍奇金(R/R cHL)患者,旨在评估acimtamig(200mg或300mg)联合AB-101的疗效和安全性。结果显示,14例患者实现完全缓解(CR),ORR为88%(21/24)。安全性方面,最常见的TRAE是输注相关反应。没有患者因TRAE停药或死亡。
产品:ISB 2001
药物靶点+类型:BCMA/CD38/CD3三抗
公司:Ichnos Sciences
全球研发赛道排名:1/2
本次披露了ISB 2001 I期研究剂量递增阶段的数据,评估其在RRMM患者中的安全性、耐受性、疗效、药代动力学(PK)和药效动力学(PD)。
截至2025年1月13日,24例患者接受了8个剂量水平(5-1800 g/kg)的治疗,中位随访6个月(范围2-12)。最高剂量组DL9(2700 g/kg)目前正在入组。所有8个剂量组的ORR达75%,包括严格完全缓解(sCR)率13%、完全缓解(CR)率为13%、非常好的部分缓解(VGPR)率为38%、部分缓解(PR)率为13%。
从最低50 g/kg剂量组即观察到缓解(MRD阴性sCR), 50 g/kg剂量组ORR达82%。中位缓解时间36天。ISB 2001呈现近似剂量线性的PK特征、 10 天的半衰期和一致的T细胞活化,支持其作用机制。
安全性方面,未观察到DLT、导致停药的不良事件(AE)或死亡病例。33%(8/24)患者报告严重AE。54%(13/24)患者出现药物相关3-4级AE。70.8%(17/24)患者发生细胞因子释放综合征(CRS),主要为1-2级,中位发生时间3天,中位持续时间2天。未报告神经毒性或效应细胞相关神经毒性综合征(ICANS)。
产品:obrixtamig
药物靶点+类型:DLL3/CD3双抗
公司:勃林格殷格翰
全球研发赛道排名:2/12
Obrixtamig联合拓扑替康治疗晚期小细胞肺癌(SCLC)患者的Ib期AREONTM-9研究中期分析结果显示,可评估患者(n=23)中,未确认的ORR为70%(95% CI 47 87),其中CR1例(4%),PR15例(65%);DCR为87%(95% CI 66 97)。在13例接受 2次基线后肿瘤评估(随访 13周)的患者中,确认的ORR为69%。中位缓解持续时间未达到。
安全性方面,obrixtamig相关不良事件(AEs;任意级别/ 3级)发生率为23例(92%)和7例(28%),无5级AEs。无患者因治疗相关AEs停用obrixtamig。未观察到 2级神经系统事件。所有CRS均为低级别:1级(44%)和2级(4%)。
此外,还有一项obrixtamig针对高或低DLL3表达的肺外神经内分泌癌(epNEC)患者的I期研究披露了相关数据。
截至2024年6月21日,共纳入60例epNEC患者(胃肠胰来源[GEP]:45.0%,泌尿生殖系统来源[GU]:30.0%,其他/原发灶不明:25.0%),其中DLL3高表达组与低表达组各30例。所有患者均接受过系统性治疗,其中DLL3高表达组30.0%、低表达组50.0%的患者既往接受过>2线治疗。
Obrixtamig治疗后,DLL3高表达患者的ORR、DCR和DOR均优于DLL3低表达患者。DLL3高表达的GEP(50.0%)和GU(60.0%)来源epNEC患者缓解率最高。7例DLL3高表达患者仍在接受治疗。两组中大多数治疗相关不良事件(TRAEs)为轻度至中度。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 肠道菌群还能操控皮肤炎症?清华大学最新Immunity论文,揭示肠道菌群代谢物驱动银屑病炎症的机制 (2025-09-11)
- 构建中国人衰老时钟,200多位中国学者联合推出X-Age项目(耄耋计划),推动健康长寿研究 (2025-09-11)
- 参天公司青光眼引流器"港澳药械通"上市许可获广东省药监局批准 (2025-09-10)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















