J Control Release:肠道微生态的“纳米信使”——细菌囊泡如何重塑胃肠健康并开启疾病治疗新范式 |
 |
J Control Release:肠道微生态的“纳米信使”——细菌囊泡如何重塑胃肠健康并开启疾病治疗新范式
来源:100医药网 2025-06-27 10:51
细菌细胞外囊泡(bEVs)在胃肠道疾病治疗中具独特优势,其天然特性与工程化改造可调节肠道菌群、修复屏障、调控免疫及改善肿瘤微环境,是极具潜力的治疗新平台。在现代快节奏的生活中,胃肠道疾病如炎症性肠病、等已成为困扰众多人群的健康难题。传统治疗手段如长期用药或手术往往伴随药物依赖、肠道菌群失调等副作用,寻找安全有效的新型疗法迫在眉睫。
近期,J Control Release发表的一篇综述Engineered bacterial extracellular vesicles for gastrointestinal diseases揭示了细菌细胞外囊泡(bEVs)在胃肠道疾病治疗中的巨大潜力,为该领域带来了全新的研究思路。

细菌细胞外囊泡的独特优势与作用机制
bEVs是细菌分泌的纳米级囊泡,具有天然的生物相容性和低原性,这使其在药物递送中展现出独特优势。其磷脂双层结构与宿主细胞相似,可高效穿透肠道黏液屏障,避免被免疫系统快速清除。更重要的是,bEVs能装载多种生物活性分子,如蛋白质、核酸和代谢产物,调控肠道生理功能。
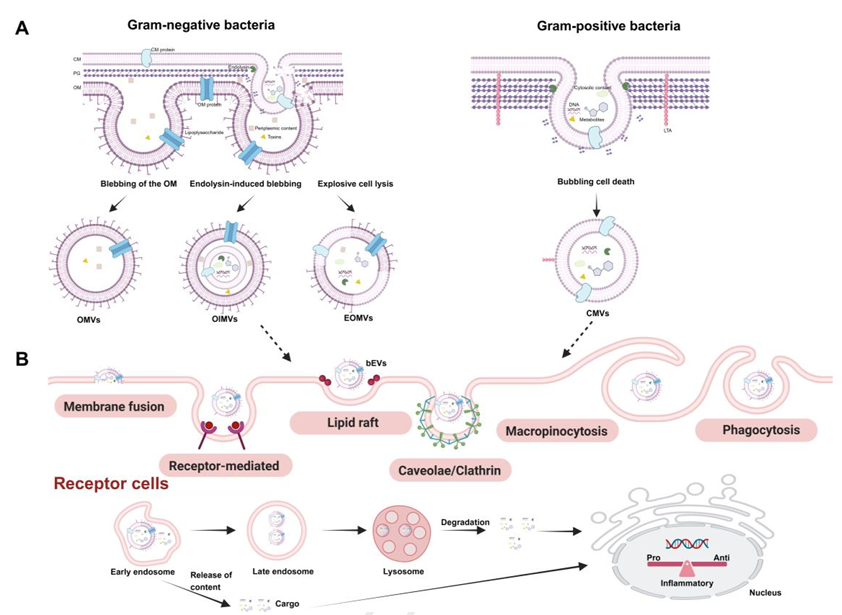
图 1. 细菌细胞外囊泡(bEVs)的生物发生与内化机制
在调节肠道菌群平衡方面,bEVs表现出色。研究发现,丁酸梭菌来源的bEVs可增加结肠炎模型小鼠肠道中产短链脂肪酸的梭菌属丰度,同时抑制大肠杆菌等有害菌增殖。Akkermansia muciniphila的bEVs则能特异性促进有益菌Bacteroides的生长,通过选择性膜融合直接刺激其增殖,重塑肠道微生态。此外,Roseburia intestinalis的bEVs含有的三肽IPI,可特异性促进短双歧杆菌生长,为恢复肠道菌群稳态提供了新靶点。
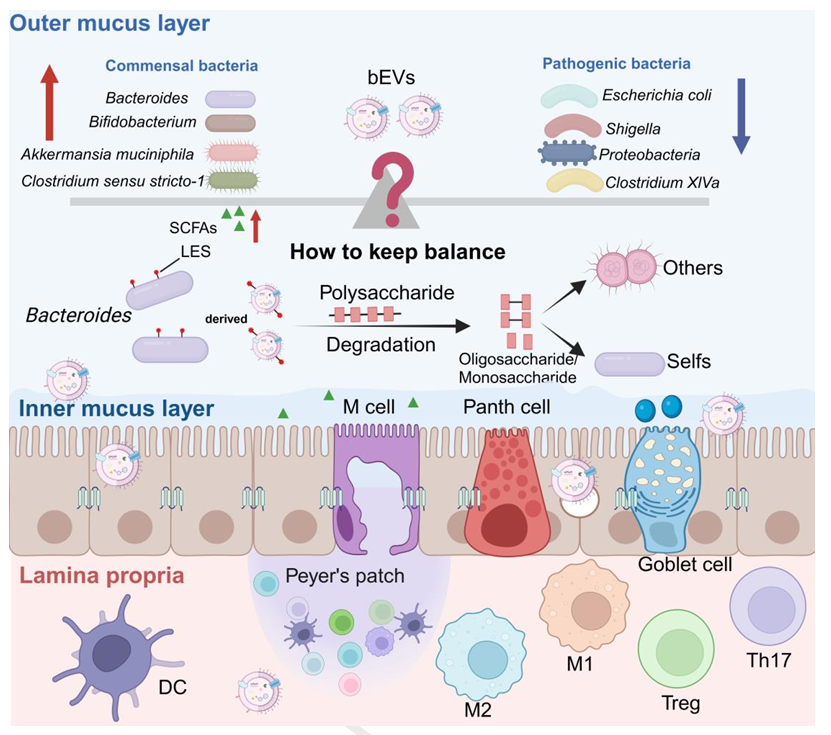
图 2. bEVs对肠道微生物群组成的调控作用
修复肠道屏障损伤是bEVs的另一重要功能。长双歧杆菌NSP001的bEVs可增加杯状细胞数量,促进黏蛋白MUC2分泌,增强肠道黏液屏障。Lactobacillus kefirgranum PRCC-1301的bEVs能上调紧密连接蛋白ZO-1、claudin-1的表达,显著改善肠上皮通透性。机制研究表明,A. muciniphila的bEVs可激活AMPK信号通路,通过调节紧密连接蛋白的空间分布修复屏障功能。
bEVs在免疫调节领域的作用同样令人瞩目。Fusobacterium nucleatum的bEVs通过TLR2依赖途径激活肠上皮细胞NF- B信号,启动先天免疫应答。长双歧杆菌的bEVs可抑制RAW264.7细胞中M1型巨噬细胞极化,通过STAT3通路减少促炎因子分泌。Lactobacillus johnsonii的bEVs则促进M2型巨噬细胞极化,通过抑制MAPK信号缓解肠道炎症。此外,Bacteroides thetaiotaomicron的bEVs可诱导树突状细胞分泌IL-10,调节T细胞分化,建立免疫耐受。
针对胃肠道肿瘤,bEVs展现出多维度治疗潜力。E. coli的bEVs可通过IFN- 依赖途径激活CD8+T细胞,抑制肿瘤生长。A. muciniphila的bEVs携带的乙酰转移酶能增加H3K14乙酰化,激活热休克蛋白70,增强CTLs杀伤活性。Parabacteroides distasonis的bEVs可上调CXCL10表达,促进CD8+T细胞浸润,重塑肿瘤微环境。同时,bEVs还能直接诱导肿瘤细胞凋亡,如E. coli的bEVs通过上调Bax、下调Bcl2蛋白表达,抑制CT26细胞增殖。
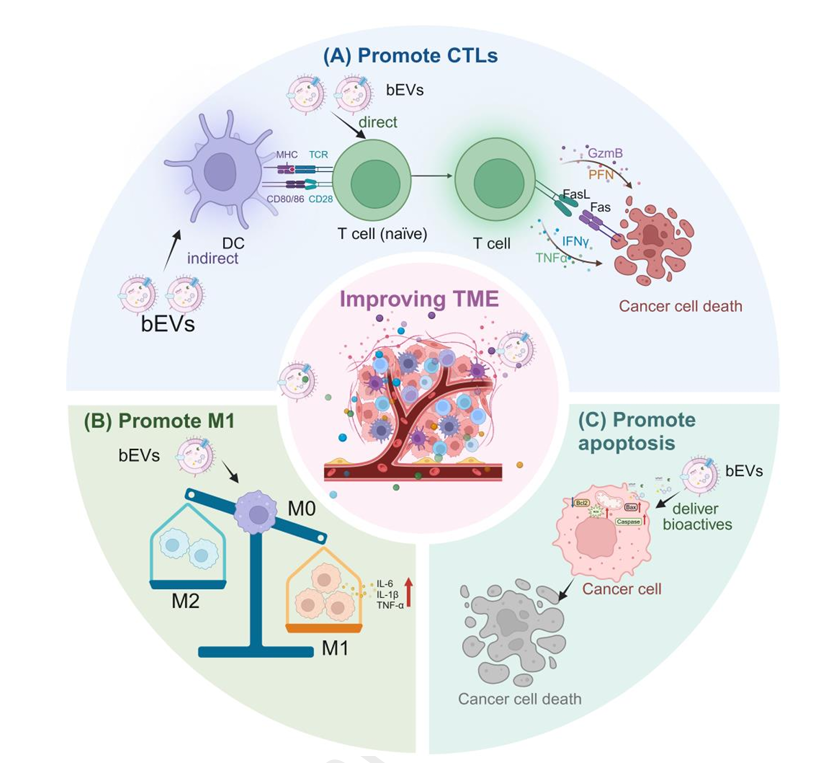
图 3. bEVs对肿瘤微环境的改善作用
工程化改造提升bEVs治疗性能
尽管天然bEVs具有诸多优势,但其靶向性和载药量等仍需优化。通过基因工程改造母菌是提升bEVs性能的有效手段。敲除Tol-Pal系统相关基因可增加bEVs产量,过表达外膜蛋白酶OmpT能促进囊泡释放。将PD-1与ClyA蛋白融合表达于bEVs表面,可特异性阻断肿瘤细胞PD-L1,逆转免疫抑制微环境。此外,糖工程技术使bEVs表面展示肺炎链球菌荚膜多糖CPS14,为肿瘤疫苗开发提供了新思路。
化学与物理修饰方法进一步拓展了bEVs的应用场景。膜融合技术将bEVs与光敏脂质体结合,构建的hybrid囊泡可同时递送CD38靶向siRNA和PD-1抗体,实现光热-免疫联合治疗。RGD肽修饰的bEVs可靶向整合素高表达的肿瘤细胞,载药量较传统纳米载体提高100倍。电技术则实现了siRNA和金纳米颗粒的高效装载,为基因治疗开辟了新途径。
临床转化前景与挑战
目前,bEVs在胃肠道疾病治疗中已展现出显著的基础研究成果,但其临床转化仍面临诸多挑战。分离纯化技术的标准化是首要难题,现有的超离心和超滤方法耗时低效,微流控技术和生物反应器连续培养有望解决这一问题。生产过程中培养基参数如pH、温度等对bEVs成分的影响需深入研究,以建立标准化的生产质控体系。
尽管如此,bEVs凭借其天然的生物学特性和可工程化优势,已成为胃肠道疾病精准治疗的理想候选。从调节肠道菌群到重塑微环境,从修复肠道屏障到精准药物递送,bEVs为多种胃肠道疾病提供了全新的治疗策略。随着合成生物学和纳米生物技术的飞速发展,定制化bEVs有望成为未来胃肠道疾病个体化治疗的核心平台,为患者带来新的希望。(100yiyao.com)
参考文献:
Nie X, Li Q, He Y, et al. Engineered bacterial extracellular vesicles for gastrointestinal diseases.J Control Release. Published online June 19, 2025. doi:10.1016/j.jconrel.2025.113972
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:想要做出颠覆性研究?多吸纳新手研究人员 (2025-10-08)
- 震惊!我国年轻、不吸烟女性肺癌发病率超男性!多项研究:40岁以下、不抽烟女性肺癌率翻倍,特别是东部沿海城市,普遍存在EGFR突变 (2025-10-07)
- Cell:空间组学终极方案?RAEFISH实现单分子与全基因组的“鱼与熊掌兼得” (2025-10-07)
- Nature Medicine:“减肥神药”的另一面:司美格鲁肽如何逆转“脂肪肝”的宿命? (2025-10-07)
- 世界首例!我国科学家创造出通用O型肾脏,并进行了首次人体移植试验 (2025-10-07)
- 研究发现组蛋白甲基转移酶组分的分子机制 (2025-10-06)
- Nature Genetics:陈万泽团队开发单细胞转录因子测序技术,剖析转录因子剂量对细胞重编程异质性的影响 (2025-10-06)
- Cell:“鱼与熊掌兼得”!王思远团队开发单分子分辨率、覆盖全基因组的空间转录组学新技术 (2025-10-05)
- Curr. Biol.:中科院物理所李岩研究组在觅食节律行为的神经机制研究方面取得重要进展 (2025-10-05)
- 水飞蓟宾护肝哪个牌子效果最好?护肝片哪个品牌最好最安全?2025口碑护肝产品公布 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















