CAR-T细胞疗法研究进展(第49期) |
 |
(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞疗法。该疗法是一种出现了很多年但近几年才被改良,并使用到临床中的新型细胞疗法。在急性和非霍奇金的治疗上有着显著的疗效,被认为是最有前景的方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点!
1. ,且不会影响健康组织
DOI: 10.1016/j.cell.2025.03.017
在癌症治疗领域,一场跨越二十年的科学接力正酝酿着革命性突破。在一项新的研究中,来自蒙特利尔大学和美国国家癌症研究所等研究机构的研究人员成功地创造了更有效的免疫细胞,可以在不损害健康组织的情况下对抗癌症。相关研究结果发表在Cell杂志上。
研究团队整合Altan-Bonnet实验室的高通量机器人平台(单日可分析 104个T细胞-靶细胞互作事件)与Fran ois教授团队的多尺度数学模型,首次揭示T细胞受体(TCR)的双向调控奥秘:"TCR不仅是免疫应答的加速踏板,更可化身刹车系统。"
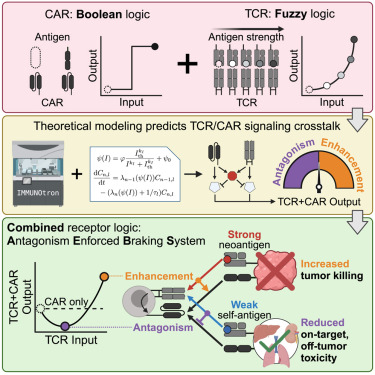
究团队充分利用了T细胞中天然存在的受体 T细胞受体(TCR),其中TCR可以通过识别不同的细胞表面蛋白来区分健康细胞和癌细胞。但是以往的研究表明,TCR在对抗肿瘤方面并不是很有效。
尽管如此,研究团队还是成功地将这两种策略混合在一起,设计出了包含TCR的CAR-T细胞。通过数学建模,他们发现:当TCR与健康细胞表面蛋白弱结合时,会激活抑制信号抵消CAR的攻击指令;而与癌细胞强结合时则增强杀伤力。基于此原理开发的"拮抗强制制动系统"(AEBS),使免疫细胞能在肿瘤微环境中精准切换"战斗模式"与"保护模式"。
在人源化实体瘤小鼠模型中,新型双TCR/CAR T细胞展现惊人表现:这些双TCR/CAR T细胞在抗癌效果上比传统CAR T细胞提升了50%,同时对健康组织的毒性降低了90%!"我们首次证明,利用受体间的天然抑制对话,能让免疫系统像外科医生一样精准切割肿瘤。"研究团队兴奋地指出。
2.
DOI: 10.1016/j.cell.2025.02.035
癌症治疗的战场上,免疫细胞如同机体的 特种部队 ,而CAR-T细胞疗法则是近年来备受瞩目的 尖兵利器 。然而,面对狡猾的实体肿瘤,传统的CAR-T细胞疗法常常力不从心,就像战士们在战场上遇到了坚固的堡垒难以攻克。近日,南加州大学的研究人员在《Cell》上发表了一项题为 Engineering sonogenetic EchoBack-CAR T cells 的研究报告,开发出了一种名为EchoBack-CAR T细胞的新技术,有望成为实体肿瘤治疗的 游戏规则改变者 。
在这项研究中,研究人员通过创新性设计成功开发出了EchoBack-CAR T细胞,为实体肿瘤治疗带来了新的曙光。EchoBack-CAR T细胞的核心优势在于其独特的设计和卓越的性能。

研究人员筛选出一种超敏感的热休克启动子,并将其与CAR信号的正反馈环路整合,使得EchoBack-CAR T细胞能在聚焦超声(FUS)刺激下实现持久的CAR表达。以针对神经节苷脂GD2的EchoBack-hGD2CAR T细胞为例,其在3D胶质母细胞瘤(GBM)模型中展现出了强大的细胞毒性和持久性。在小鼠实验中,EchoBack-hGD2CAR T细胞能有效抑制GBM的生长,且没有出现靶向错误的毒性反应,同时还能表现优于传统的CAR T细胞的功能。
在这项研究中,研究人员通过创新性设计成功开发出了EchoBack-CAR T细胞,为实体肿瘤治疗带来了新的曙光。EchoBack-CAR T细胞的核心优势在于其独特的设计和卓越的性能。
研究人员筛选出一种超敏感的热休克启动子,并将其与CAR信号的正反馈环路整合,使得EchoBack-CAR T细胞能在聚焦超声(FUS)刺激下实现持久的CAR表达。以针对神经节苷脂GD2的EchoBack-hGD2CAR T细胞为例,其在3D胶质母细胞瘤(GBM)模型中展现出了强大的细胞毒性和持久性。在小鼠实验中,EchoBack-hGD2CAR T细胞能有效抑制GBM的生长,且没有出现靶向错误的毒性反应,同时还能表现优于传统的CAR T细胞的功能。
3.
DOI: 10.1182/blood.2024025440
B细胞急性(B-cell acute lymphoblastic leukemia, B-ALL)是一种危及生命且具有高度侵袭性的癌症。它是最常见的儿童癌症,占儿科癌症病例的35%,但它可以影响任何年龄的人。CAR-T细胞疗法显著改善了B-ALL患者的预后,但超过50%的病例仍会复发,使许多患者的治疗选择有限。正在进行的研究旨在应对这一挑战并提高CAR-T疗法的有效性。
CAR-T细胞疗法治疗B-ALL的主要挑战之一是复发。科学家们正在研究的一个关键问题是,为什么CAR-T细胞作为一种活细胞药物,有时即使在癌细胞存在的情况下也不会对其产生反应。在一项新的研究中,研究人员通过研究和免疫细胞(包括CAR-T细胞)之间的相互作用,发现了一条有前景的线索。相关研究结果发表在Blood 杂志上。
这项研究证实,B-ALL可能利用身体的天然防御机制,特别是免疫检查点途径。这些途径通常充当 关闭开关 ,告诉免疫细胞在感染或威胁清除后停止攻击。然而,B-ALL可以劫持这个系统来避免被免疫系统攻击。
就B-ALL而言,研究人员发现复发的B-ALL白血病细胞具有异常高的galectin-9水平,其中galectin-9是免疫检查点系统的一部分。另一方面,CAR-T细胞表达高水平的TIM-3,而TIM-3是一种通常与galectin-9相互作用以抑制免疫活性的受体。B-ALL似乎利用这种相互作用来 关闭 CAR-T细胞,从而使癌症持续存在。
为了解决这个问题,研究人员创造了一种TIM-3诱饵,即TIM-3蛋白的可溶性版本,可以阻断这种配体-受体相互作用。这个想法是,这种诱饵可以阻止B-ALL关闭CAR-T细胞,而无需直接向它们发出停止免疫活动的信号。
在使用带有人类B-ALL细胞的转基因小鼠进行的实验室测试中,他们的研究结果很有希望。经过基因改造后可分泌TIM-3诱饵的CAR-T细胞显示出更好的抗白血病效果和长期持久性。
4.
DOI:10.1038/s41591-025-03499-9
来自莱比锡大学医学中心、弗劳恩霍夫细胞治疗与免疫学研究所和科隆大学医院的研究人员在一项发表在Nature Medicine期刊上的标题为 Multiomic profiling of T cell lymphoma after therapy with anti-BCMA CAR T cells and GPRC5D-directed bispecific antibody 的研究中发现并分析了一种创新形式的血癌疗法的罕见但严重的副作用。
一名63岁的患者在科隆大学医院接受CAR-T细胞治疗9个月后,血液、皮肤和肠道中出现了T细胞淋巴瘤。这种肿瘤是由治疗中使用的转基因T细胞发展而来的。
论文共同通讯作者Maximilian Merz教授说, 这是CAR-T细胞治疗后首次记录的此类淋巴瘤病例之一。这项研究的结果将有助于我们更好地了解与这种治疗相关的风险,并可能在未来预防这些风险。
5.
DOI:10.1038/s41586-025-08657-0
CAR-T细胞疗法是近年来出现的最有前途的癌症新疗法之一。它涉及提取患者自身的T细胞,并对其进行基因改造,以识别癌细胞表面上的特定靶点。这类称为自体疗法的CAR-T细胞疗法的一个主要局限性在于,提取自患者自身的T细胞必须定制成一种治疗方案。这意味着患者需要等待他们的T细胞接受修饰才能进行输注 而他们可能没有宝贵的时间来等待。
如今,在一项新的研究中,来自纪念斯隆-凯特琳癌症中心(MSK)的研究人员在这一领域取得了新的进展,有可能使用由健康供体提供并储存的现成CAR-T细胞,以便在患者需要时立即准备好。他们确定了一种对供体CAR-T细胞 也称为异体CAR-T细胞(allogeneic CAR T cell),进行修饰的方法,这样它们就不会被接受它们的患者排斥,并将继续与癌症作斗争。
相关研究结果于2025年1月30日在线发表在Nature期刊上,论文标题为 HIV immune evasin Nef enhances allogeneic CAR T cell potency 。这项研究是在Michel Sadelain博士的实验室进行的。Sadelain博士是CAR-T细胞治疗的先驱。
这种新方法涉及为CAR-T细胞配备一种名为Nef的蛋白。这些作者发现,在癌症小鼠模型中,将Nef插入供体CAR-T细胞能够使这些细胞存活并保持效力。论文第一作者、纪念斯隆-凯特琳癌症中心医学博士Karlo Perica说, 这可能是朝着创造安全有效的异体CAR-T细胞迈出的重要一步,这将大大增加可以从这种免疫疗法中受益的患者数量。
6.
DOI:10.1038/s41467-024-54794-x
嵌合抗原受体(CAR)T细胞疗法是一种极具前景的癌症治疗方法,但如何增强其疗效一直是个谜。近日,一篇发表在国际杂志Nature Communications上题为 Cullin-5 deficiency promotes chimeric antigen receptor T cell effector functions potentially via the modulation of JAK/STAT signaling pathway 的研究报告中,来自日本名古屋大学等机构的研究人员发现了一种提高这种潜在癌症疗法效果的方法:通过修饰一个特定基因,可以在长时间内增强免疫细胞对抗癌症的能力,从而可能降低癌症复发的机会。
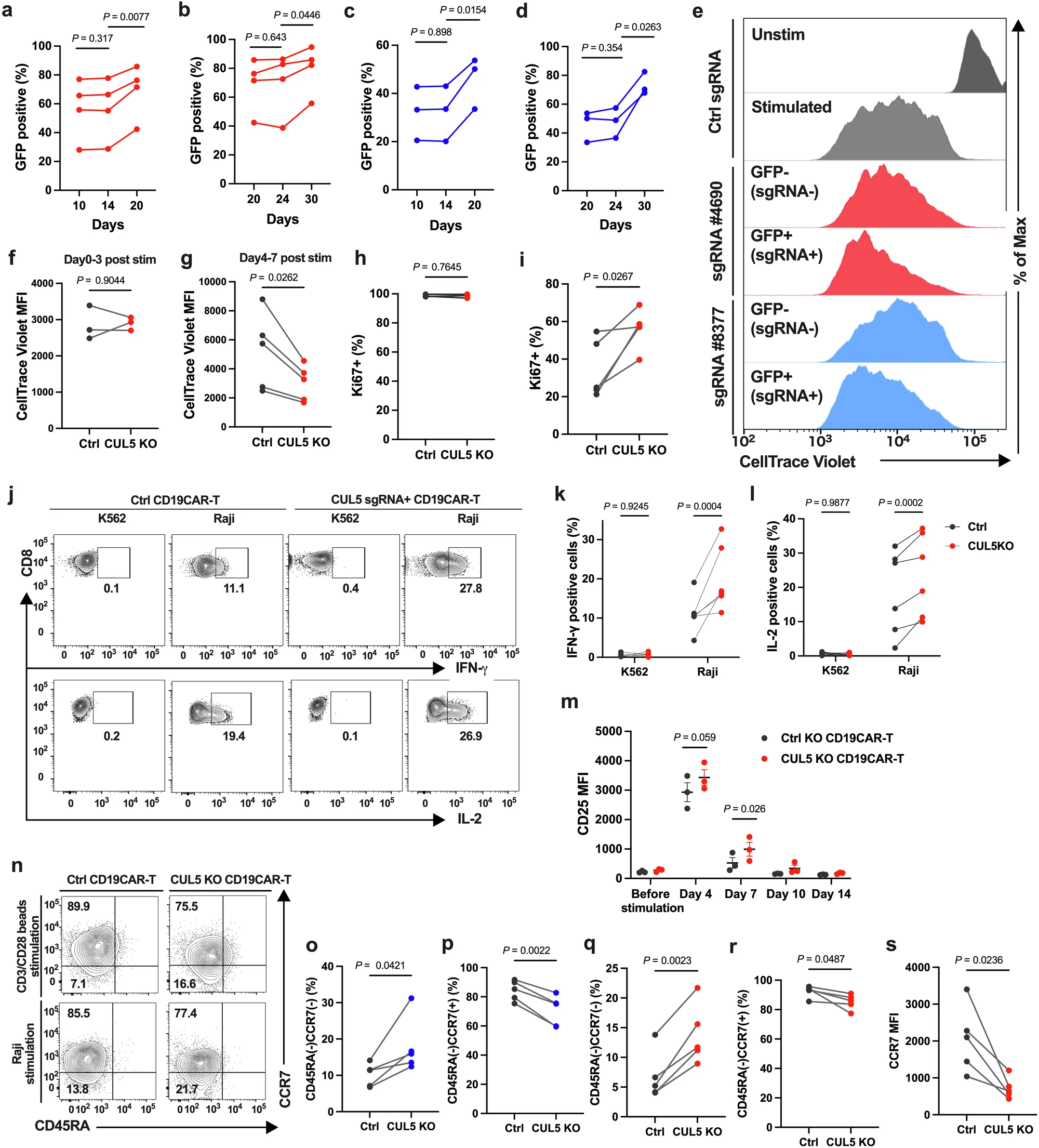
研究人员指出,减少CUL5基因的活性可以增强CAR-T细胞的抗癌效应,进而改善多种侵袭性癌症(如白血病、淋巴瘤和多发性骨髓瘤)患者的治疗效果。CAR-T细胞疗法是一种针对晚期癌症的创新疗法,科学家们会在实验室中对患者自身的免疫T细胞进行遗传改造,加入嵌合抗原受体(CAR),使这些细胞能够靶向并消灭癌细胞。在这项研究中,研究人员专注于能靶向B细胞表面CD19蛋白的CAR,因为B细胞是诸如白血病等疾病中发生癌变的特殊免疫细胞类型。
尽管临床医生已经成功使用这种疗法治疗了许多患者,但很多患者仍然会因癌变细胞产生的敌对环境而经历癌症复发。当CAR-T细胞反复接触癌细胞后,它们会失去分裂和有效攻击肿瘤的能力。
为了找到解决这一问题的办法,研究人员利用CRISPR筛选技术识别出那些能够提升CAR-T细胞疗法效果的基因。CRISPR允许科学家关闭细胞中的单一基因,并观察哪些基因对于特定功能至关重要。
结果发现,CUL5基因参与了细胞内某些蛋白质的分解过程。当CUL5不活跃时,JAK-STAT信号通路变得更加持久,这条通路会发送信号鼓励T细胞生长和繁殖,从而更好地应对癌症。
7.
DOI:10.1016/j.omtm.2024.101385
在一项新的研究中,来自南卡罗来纳医科大学霍林斯癌症中心的研究人员揭示了如何设计嵌合抗原受体(chimeric antigen receptor, CAR)Treg细胞的新规则。这一突破可能为对抗1型等自身免疫性疾病提供更有效的工具。相关研究结果近期发表在Molecular Therapy - Methods Clinical Development期刊上,论文标题为 High-affinity chimeric antigen receptor signaling induces an inflammatory program in human regulatory T cells 。
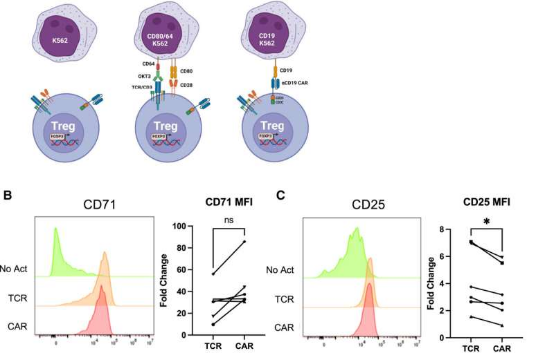
CAR-T细胞疗法已经在血癌治疗中取得了显著成功。这种疗法通过给患者自身的T细胞添加CAR,使它们能够识别并攻击特定的癌细胞。但是,当涉及到自身免疫疾病时,事情变得复杂起来。为了有效治疗这些疾病,Treg细胞必须被改造得更加精准和高效。
在这项研究中,研究人员发现了一个关键问题:目前使用的CAR构造体并没有针对Treg细胞的生物学特性量身定制,导致这些细胞产生不必要的炎症信号,这与它们原本应该减缓炎症的目标背道而驰。
第一作者Russell Cochrane说, 我们尝试通过降低CAR的亲和力 即它与靶标的结合程度 来解决这个问题。这样做后,我们发现它仍然可以通过多种机制抑制免疫反应,同时减少了促炎后果。
论文通讯作者Leonardo Ferreira博士表示, 这项研究为我们实现Treg细胞治疗的承诺提供了新的线索。我们知道这是可能的,我们将继续努力。 研究人员正在探索不同的靶标选择策略,以更好地适应不同类型的疾病。例如,在器官移植中,目标是让免疫系统正常运作,而不是像传统做法那样广泛抑制整个免疫系统。
8.
DOI:10.3324/haematol.2024.286169
嵌合抗原受体(CAR)T细胞疗法是一种癌症免疫疗法。在这种免疫疗法中,科学家们收集患者的T细胞并对其进行基因修饰,以产生识别癌细胞表面上特定靶点的CAR,使这些T细胞能够定位并摧毁癌细胞。
CAR-T细胞疗法在治疗复发性或难治性B细胞淋巴瘤方面显示出有希望的结果。在一项新的研究中,来自日本顺天堂大学的研究人员,包括Jun Ando教授、Miki Ando教授和Erina Hosoya博士,探索了与CAR-T细胞疗法相关的风险。相关研究结果近期发表在Haematologica 期刊上,论文标题为 Eleven cases of laryngeal edema after tisagenlecleucel infusion: a 3-year single center retrospective study of CD19-directed chimeric antigen receptor T-cell therapy for relapsed and refractory B-cell lymphomas 。
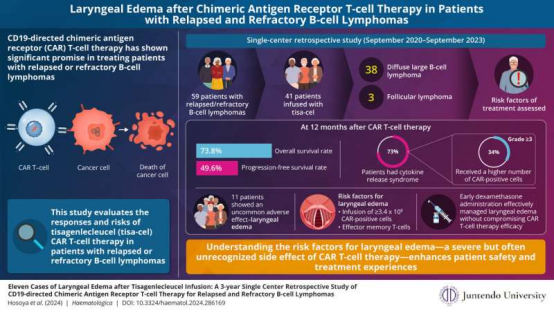
Hosoya博士说, 我们对2020年9月至2023年9月期间接受tisagenlecleucel(tisa-cel)CAR-T细胞治疗的59名复发/难治性B细胞淋巴瘤患者进行了单中心回顾性分析。41名研究患者(38名患有(DLBCL)和3名患有(FL))接受了tisa-cel输注。37名DLBCL患者和1名FL患者完成了反应评估。
这些作者在12个月内跟踪了总生存率(OS)和无进展生存率(PFS),发现OS为73.8%,PFS为49.6%。安全性监测显示,41名接受tisa-cel治疗的患者中有30名出现了细胞因子释放综合征(CRS),这是一种炎症副作用。
在这30名出现CRS的患者中,14人出现更严重的CRS(3级或更高),并且倾向于接受更高剂量的CAR阳性细胞,与较轻的CRS(1级或2级)患者相比,会导致更早的。
这些作者发现,患者中有11例喉部水肿,这是CAR-T细胞治疗的一种严重且以前未被认识的副作用。最初认为只影响颈部,但在所有患者中都发现了这种情况,无论肿瘤位于何处。由于喉部水肿引起的阻塞,提供了重症监护和气道。这种情况通常在输注后3.4天内出现,所有患者在14天内消失。
Hosoya博士说, 尽管出现了一些使用tisa-cel治疗B细胞淋巴瘤的喉水肿病例报告,但这种现象的机制仍然未知,而且尽管存在危及生命的气道阻塞的主要风险,但目前还没有既定的管理。因此,我们评估了喉部水肿发生的风险因素以及类固醇治疗对CAR-T细胞扩增和临床结果的影响。
9.
DOI:10.1016/j.ymthe.2024.12.012
在一项新的研究中,悉尼大学医学与健康学院儿童医学研究所的Leszek Liowski副教授及其团队确定了一种生产治疗产品 嵌合抗原受体(CAR)T细胞的新方法,该方法有可能改善对癌症的治疗。相关研究结果近期发表在Molecular Therapy期刊上,论文标题为 Tailoring capsid-directed evolution technology for improved AAV-mediated CAR-T generation 。
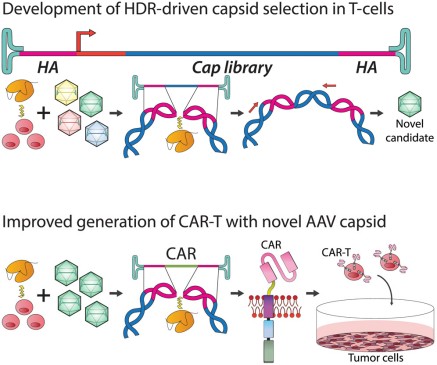
近年来,CAR-T细胞技术的进步包括使用新的病毒载体将功能性CAR传递给患者的T细胞,以产生治疗性CAR-T细胞产品。基于内在的安全性,最常用于直接向患者传递治疗基因的AAV载体是CAR-T细胞产品的下一个前沿。
在这项研究中,Liowski副教授和他的团队,包括论文共同作者Adrian Westhaus,开发了一种新的方法来构建新的定制AAV变体,使其能够更有效地靶向患者的T细胞,从而将其定位为CAR-T细胞产品开发的下一代AAV载体。
在这项概念验证研究中,Liowski团队发现了这种显著降低的病毒载体剂量不仅可以降低未来CAR-T细胞产品的成本,而且更重要的是,该团队还能够证实,使用这些新AAV开发的治疗性CAR-T细胞以更高的效率杀死癌细胞,从而也有可能提高新疗法的治疗效力。
10.
DOI:10.1038/s41590-024-02042-1
嵌合抗原受体T细胞(CAR-T细胞)具有T(TSCM)样的表型特征,能促进持续性的抗肿瘤效应。近日,一篇发表在国际杂志Nature Immunology上题为 A multi-kinase inhibitor screen identifies inhibitors preserving stem-cell-like chimeric antigen receptor T cells 的研究报告中,来自北卡罗来纳大学等机构的科学家们通过进行一项临床前研究后识别出了一种由三种不同药物组成的混合制剂,其或能被用来产生更强大的免疫系统CAR-Ts(嵌合抗原受体T细胞)从而抵御癌症,这一研究发现对于改善临床使用的CAR-T细胞的生产也有着重要影响。
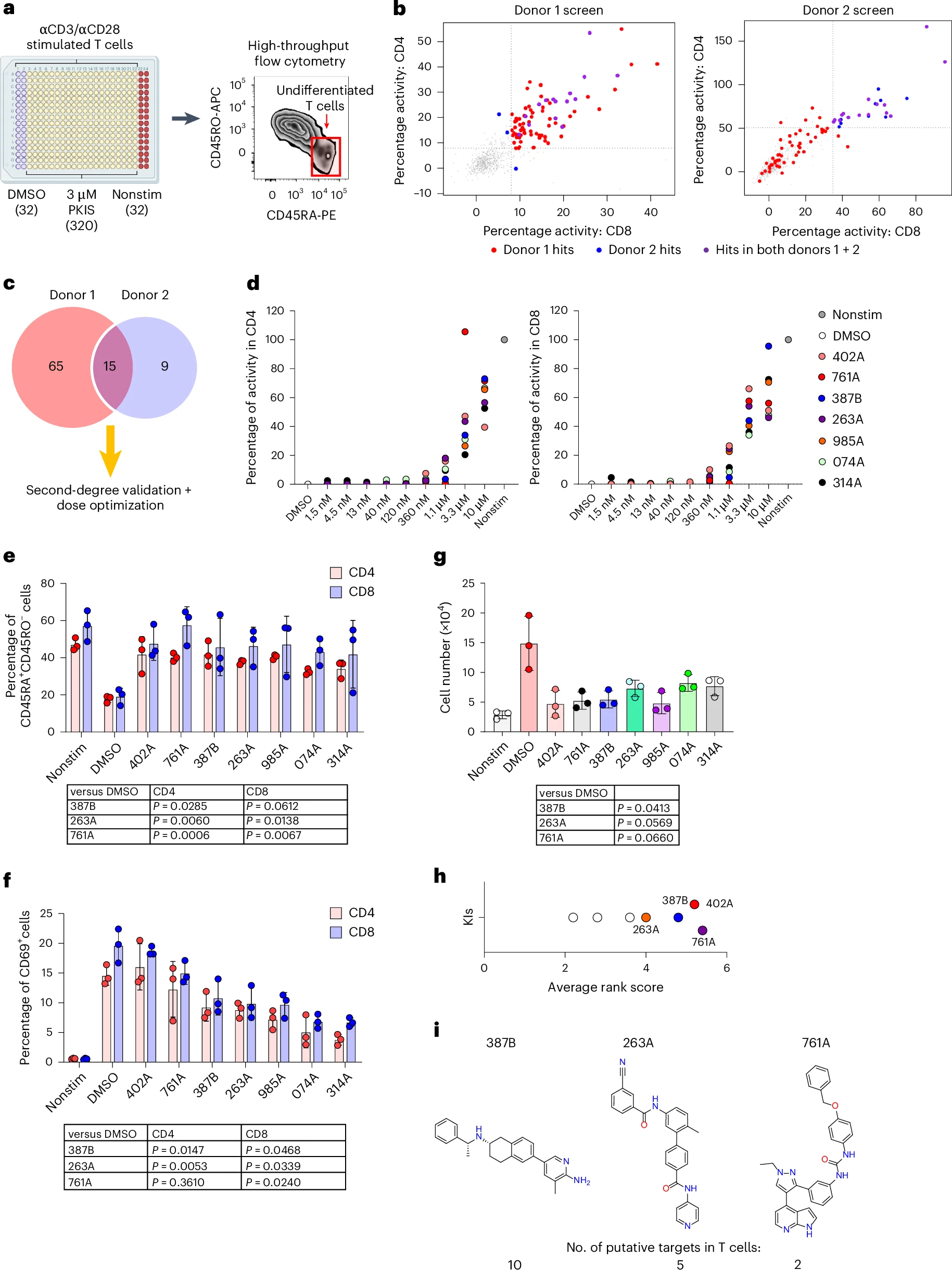
CAR-T细胞免疫疗法包括从患者机体中收集免疫系统T细胞,随后在实验室中对其进行遗传工程化改造,以便其被重新输注回患者体内后能识别癌细胞表面的靶点,利用某些类型CAR-T细胞疗法治疗的患者能对癌症产生明显的反应,尤其是当重新改造的细胞含有能被T记忆干细胞(TSCM)所识别的免疫细胞亚群时。
研究者Gianpietro Dotti教授表示,在实验室中产生用于重新输注的CAR-T细胞在不同病人之间或许存在极大的不同,最终产品中缺乏某些类型的细胞则会大大降低这些细胞长期存在的能力。本文研究结果表明,在重新改造过程中识别出药物的额外添加或能促进负责长期持久性的关键细胞亚群的保存。
本文中,研究人员利用实验室实验和对小鼠进行研究后,识别出了能参与TSCM样CAR-T细胞富集的多种激酶,包括ITK, ADCK3, MAP3K4和CDK13等,尤其是,ADCK3和MAP3K4能作为T细胞中的潜在新型靶点,这就表明,研究人员还需要对其功能和型号通路进一步深入研究来揭示T细胞如何分化从而发挥重要的免疫功能。(100yiyao.com)
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 震惊!我国年轻、不吸烟女性肺癌发病率超男性!多项研究:40岁以下、不抽烟女性肺癌率翻倍,特别是东部沿海城市,普遍存在EGFR突变 (2025-10-07)
- Cell:空间组学终极方案?RAEFISH实现单分子与全基因组的“鱼与熊掌兼得” (2025-10-07)
- Nature Medicine:“减肥神药”的另一面:司美格鲁肽如何逆转“脂肪肝”的宿命? (2025-10-07)
- 世界首例!我国科学家创造出通用O型肾脏,并进行了首次人体移植试验 (2025-10-07)
- 研究发现组蛋白甲基转移酶组分的分子机制 (2025-10-06)
- Nature Genetics:陈万泽团队开发单细胞转录因子测序技术,剖析转录因子剂量对细胞重编程异质性的影响 (2025-10-06)
- Cell:“鱼与熊掌兼得”!王思远团队开发单分子分辨率、覆盖全基因组的空间转录组学新技术 (2025-10-05)
- Curr. Biol.:中科院物理所李岩研究组在觅食节律行为的神经机制研究方面取得重要进展 (2025-10-05)
- 水飞蓟宾护肝哪个牌子效果最好?护肝片哪个品牌最好最安全?2025口碑护肝产品公布 (2025-10-05)
- 脂肪肝、酒精肝吃哪种护肝片好?护肝片哪个牌子效果最好?三甲医生联合推荐十大品牌 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















