攻克“不可成药”,David Baker团队中国博后利用AI从头设计蛋白,靶向内在无序蛋白,解锁治疗靶点 |
 |
攻克“不可成药”,David Baker团队中国博后利用AI从头设计蛋白,靶向内在无序蛋白,解锁治疗靶点
来源:生物世界 2025-07-20 14:15
这两项研究中,研究团队采用了两种互补的设计策略,这两种策略基于氨基酸序列,而无需蛋白结构信息,因此,有助于在大量新的治疗靶点上实现高度通用的药物发现。在自然界中,许多蛋白质会折叠成稳定的形状。但内在无序蛋白(IDP)和内在无序区域(IDR)缺乏稳定的结构,而它们几乎占据了人类蛋白质组的一半。这些蛋白驱动着关键的细胞信号转导、应激反应以及多种疾病进展,但由于其高度的构象灵活性,长期以来一直难以研究,也难以开发靶向新药,因此也被称为 不可成药 (undruggable)靶点。
而现在,这些 不可成药 靶点不在难成药!人工智能(AI)攻克内在无序蛋白/区域,成功解锁治疗靶点。
2025 年 7 月 17 日,诺奖得主、蛋白质设计先驱David Baker教授发表了两篇新论文,利用生成式人工智能(Generative AI)设计并生成能够结合无序蛋白质/区域的结合蛋白,精度达到原子级别,从而攻克 不可成药 的疾病靶点。
David Baker教授是华盛顿大学蛋白质设计研究所的所长,他因开创性地将人工智能(AI)应用于蛋白质设计而荣获 2024 年诺贝尔化学奖。近年来,他的实验室开发了一种基于diffusion的 AI 蛋白是设计模型 RFdiffusion,能够从头设计生成自然界不存在的全新蛋白质,该方法此前已在癌症疗法、蛋白酶、蛇毒中和蛋白等领域实现了广泛应用。
已有研究尝试通过传统的动物免疫来开发靶向内在无序区域(IDR)的抗体,然而,含有 IDR 的蛋白在注射到动物体内后极易发生降解和聚集,导致难以产生抗体。此外,之前用于设计结合蛋白的计算方法依赖于对目标 IDR 几何形状的预先指定,从而限制了其通用性。
而在这两项研究中,研究团队采用了两种互补的设计策略,这两种策略基于氨基酸序列,而无需蛋白结构信息,因此,有助于在大量新的治疗靶点上实现高度通用的药物发现。
其中一篇论文发表发表于Science期刊,论文题为:Design of intrinsically disordered region binding proteins,Kejia Wu博士为第一作者兼共同通讯作者,Hanlun Jiang博士为共同第一作者,David Baker教授为通讯作者。

该研究采用了一种名为 logos 的蛋白质设计策略,它以侧链为中心,预制了一个能识别氨基酸侧链集合的 结合口袋 库(1000 个),然后使用RFdiffusion 生成结合分子,有效地将这些结合口袋连接成一个单一结构,组装成结合蛋白。
通过设计能够适配目标无序区域序列的结合口袋,为识别缺乏折叠结构域的内在无序蛋白/区域提供了一种通用解决方案。论文第一作者兼共同通讯作者Kejia Wu博士表示,为了证明这种方法确实具有通用性,我们甚至为随机序列的多肽构建了结合蛋白,1000 个预制的结合口袋能够实现数万亿种不同组合。
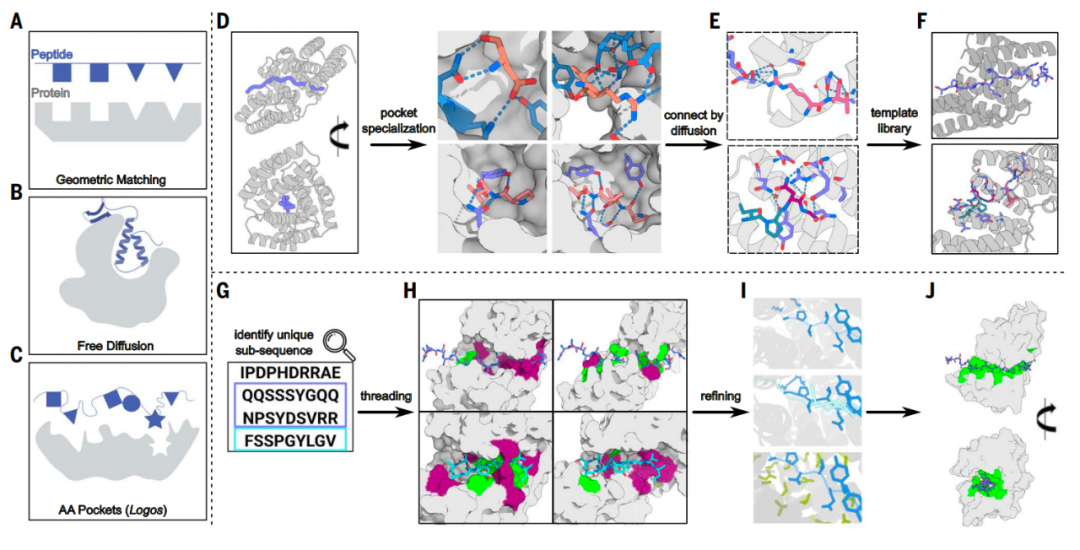
IDR 结合蛋白的设计
该研究测试了 43 个高度多样化的无序蛋白靶点(21 个疾病相关 IDR,18 个合成序列),平均每个靶点进行了 22 个设计,对其中 39 个靶点实现了紧密结合,其中 34 个结合蛋白的结合亲和力达 100 皮摩尔至 100 纳摩尔。
进一步实验验证,这些设计的结合蛋白可在细胞中发挥作用,展现出多种应用潜力:可从细胞裂解液中富集低丰度蛋白用于蛋白质组学研究;靶向癌症相关细胞膜受体的无序结构域;抑制 G 蛋白偶联受体(GPCR)信号通路;以及介导细胞内蛋白质定位调控功能。可用于癌症治疗、疾病、神经疾病干预等领域,例如,该研究中设计生成的靶向强啡肽的结合蛋白 DYNA_2b2,结合亲和力低于 100 皮摩尔,并成功在人类细胞内阻断了疼痛信号转导。
另一项研究发表在了预印本平台 bioRxiv 上,论文题为:Diffusing protein binders to intrinsically disordered proteins,Caixuan Liu博士为第一作者,David Baker教授为通讯作者,Kejia Wu博士为共同第一作者兼共同通讯作者。

该研究应用RFdiffusion设计生成了能够与各种构象的内在无序蛋白(IDP)和内在无序区域(IDR)结合的结合蛋白,该生成了胰淀素、C 肽、VP48这几种内在无序蛋白(IDP)的结合蛋白,亲和力在 3-100 纳摩尔范围内,设计生成了G3BP1、IL2RG和朊病毒这几种包含内在无序区域(IDR)的蛋白质的结合蛋白,亲和力在 3-100 纳摩尔之间。
进一步实验显示,设计生成的IL2RG 结合蛋白在细胞内与其受体共定位,为调控 IL2 信号转导开辟了新途径,设计生成的胰淀素结合蛋白能够阻止并溶解胰淀素形成与 2 型相关的淀粉样毒纤维。
论文第一作者Caixuan Liu博士表示,我们制造出了高度特异性的内在无需蛋白/内在无序区域的结合蛋白,其亲和力与自然界最强的蛋白相互作用相当,达到了纳摩尔至皮摩尔的水平 这是此前无法实现的关键能力。
在实验室测试中,设计生成的结合蛋白(紫色和粉色)包裹住具有柔韧性的胰淀素(白色),阻止其形成与 2 型糖尿病相关的淀粉样毒纤维。
这两篇论文的通讯作者David Baker教授表示,尽管这些蛋白质自身处于无序状态,但当它们与设计好的结合蛋白相互作用时,就会形成特定的结构。也就是说,设计生成的结合蛋白实际上迫使无序蛋白形成了一种非常适合结合的构象。
他还表示,这两项研究中使用的策略相互补充,基于RFdiffusion的策略在设计与具有某些螺旋和链状二级结构的靶点相结合的结合蛋白方面表现出色,而logos策略则最适合用于缺乏规则二级结构的靶点。
由于许多致病蛋白包含内在无序区域(IDR),因此,这两项研究开发的新的设计策略可能会引发一波新的治疗手段和诊断方法。值得一提的是,David Baker实验室已将这两种互补的 IDR 结合蛋白设计工具在线发布,所有研究人员均可免费使用。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 震惊!我国年轻、不吸烟女性肺癌发病率超男性!多项研究:40岁以下、不抽烟女性肺癌率翻倍,特别是东部沿海城市,普遍存在EGFR突变 (2025-10-07)
- Cell:空间组学终极方案?RAEFISH实现单分子与全基因组的“鱼与熊掌兼得” (2025-10-07)
- Nature Medicine:“减肥神药”的另一面:司美格鲁肽如何逆转“脂肪肝”的宿命? (2025-10-07)
- 世界首例!我国科学家创造出通用O型肾脏,并进行了首次人体移植试验 (2025-10-07)
- 研究发现组蛋白甲基转移酶组分的分子机制 (2025-10-06)
- Nature Genetics:陈万泽团队开发单细胞转录因子测序技术,剖析转录因子剂量对细胞重编程异质性的影响 (2025-10-06)
- Cell:“鱼与熊掌兼得”!王思远团队开发单分子分辨率、覆盖全基因组的空间转录组学新技术 (2025-10-05)
- Curr. Biol.:中科院物理所李岩研究组在觅食节律行为的神经机制研究方面取得重要进展 (2025-10-05)
- 水飞蓟宾护肝哪个牌子效果最好?护肝片哪个品牌最好最安全?2025口碑护肝产品公布 (2025-10-05)
- 脂肪肝、酒精肝吃哪种护肝片好?护肝片哪个牌子效果最好?三甲医生联合推荐十大品牌 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















