Cell子刊:姜学军团队揭示缺氧通过表观遗传调控铁死亡 |
 |
来源:生物世界 2025-07-29 09:29
该研究首次发现,缺氧通过抑制组蛋白去甲基化酶 KDM6A 活性,以缺氧诱导因子(HIF)非依赖的方式抑制铁死亡。铁死亡(Ferroptosis)是一种由铁依赖性磷脂过氧化驱动的代谢性细胞死亡过程,与包括癌症在内的多种病理状况有关。尽管诸如葡萄糖、脂质和多种氨基酸等代谢因素已被证实能够调控铁死亡,但作为另一个基本代谢成分的氧气在铁死亡中的作用,尚未被阐明。
2025 年 7 月 24日,纪念斯隆-凯特琳癌症中心姜学军教授团队在 Cell 子刊Molecular Cell上发表了题为:HIF-Independent Oxygen Sensing Via KDM6A Regulates Ferroptosis的研究论文。
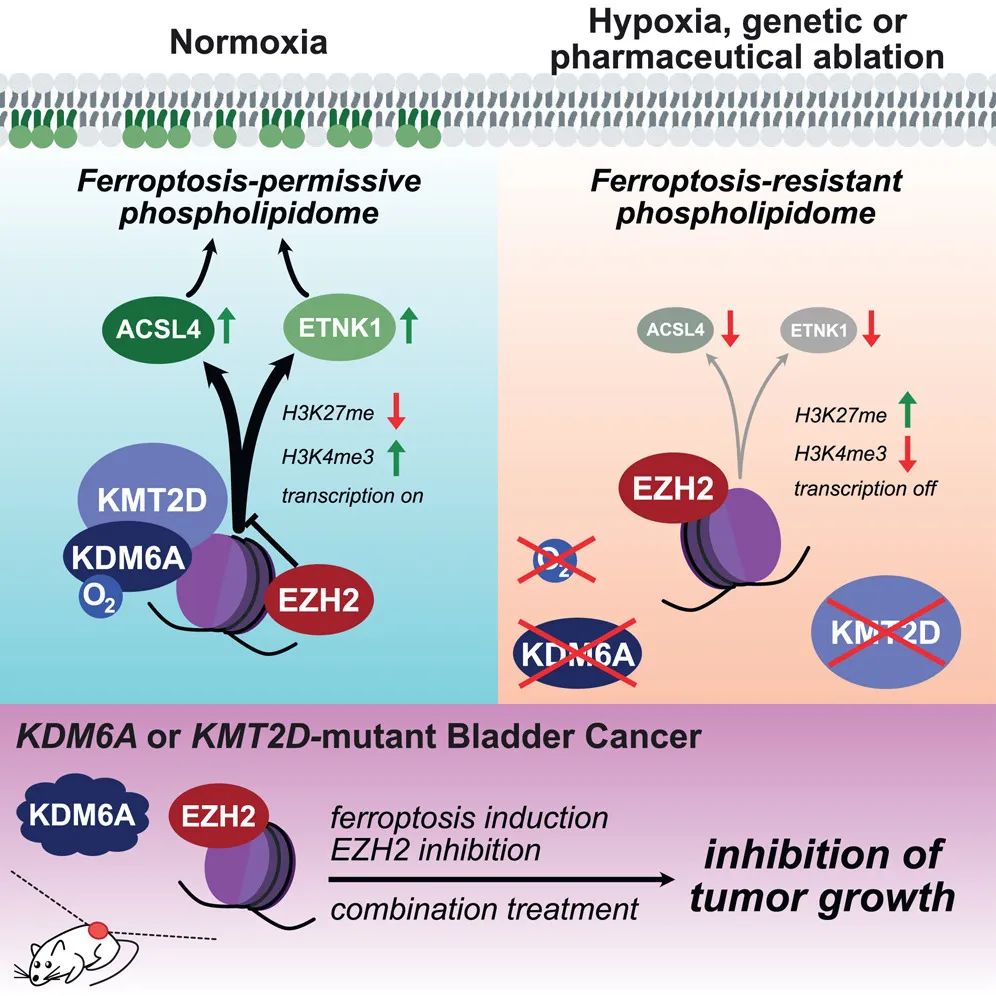
该研究首次发现,缺氧通过抑制组蛋白去甲基化酶KDM6A活性,以缺氧诱导因子(HIF)非依赖的方式抑制铁死亡。该研究明确了 KDM6A 作为非经典氧感应器在铁死亡过程中的功能,揭示了缺氧对铁死亡的调控路径不依赖于传统的 PHD-HIF 通路,在机制上具有突破性意义。
在这项最新研究中,研究团队发现,适应低氧环境的细胞对铁死亡具有显著的抗性,而且这种抗性与脯氨酰羟化酶(PHD)和缺氧诱导因子(HIF)转录因子介导的经典氧感知通路无关。
相反,缺氧通过抑制KDM6A(一种肿瘤抑制因子和氧依赖性组蛋白去甲基化酶)来抑制铁死亡,导致其转录靶点(包括脂质代谢酶 ACSL4 和 ETNK1)的表达降低,从而将细胞磷脂谱重塑为铁死亡抵抗状态。
与癌症相关的是,对致癌组蛋白甲基转移酶 EZH2 进行药理学抑制(EZH2 与 KDM6A 的活性相对立),恢复了携带 KDM6A 突变的膀胱肿瘤异种移植组织对铁死亡的敏感性。
该研究的核心发现:
长期缺氧可通过缺氧诱导因子(HIF)非依赖的方式抑制铁死亡;
缺氧通过抑制 KDM6A 重塑磷脂组以抵御铁死亡;
KDM6A 肿瘤抑制因子缺失在中常见,会导致铁死亡抵抗;
EZH2 抑制可恢复 KDM6A 突变膀胱癌的铁死亡敏感性。
 医药网新闻
医药网新闻

- 相关报道
-
- Nature子刊:浙江大学方向前/赵玥绮/唐睿康/刘昭明团队开发抗衰老的时空自适应纳米疗法 (2025-10-07)
- Neuron:大脑“超清摄像头”问世!神经观测有望进入新时代 (2025-10-07)
- 科研人员绘制图谱解析风险SNP驱动的促肿瘤机制 (2025-10-06)
- Nature子刊:邓攀团队提出AI框架——CellNavi,为细胞研究装上“导航仪” (2025-10-06)
- Nature头条:如何才能科学地睡个好觉?做到这三点至关重要 (2025-10-05)
- 中国科学院最新论文,登上Science封面 (2025-10-05)
- 《细胞》子刊:微生物守护卵巢健康!科学家发现,雌性小鼠生育年龄与微生物有关,微生物代谢物可防止卵巢储备加速流失 (2025-10-04)
- 珍·古道尔的遗产:她改变科学的三种方式 (2025-10-04)
- Nature Aging:沈舒滢/季明亮/赵兴团队发现骨关节炎治疗新靶点,并提出基于LNP-mRNA的新疗法 (2025-10-03)
- Nature Medicine:颠覆认知!体重不减反增,为何依然能逆转糖尿病前期? (2025-10-03)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















