今天长出一颗肝,明天再造一块骨!上海大学苏佳灿教授团队最新综述,详解类器官在组织修复和再生中的作用 |
 |
组织损伤和功能障碍是多种疾病和创伤的常见后果,严重影响患者的生活质量。传统的治疗方法虽然在一定程度上能够缓解症状或促进修复,但往往存在局限性,如疗效有限、恢复缓慢、再生能力不足等。
近年来,随着干细胞技术和生物材料的快速发展,类器官技术逐渐成为组织修复和再生医学领域的研究热点。
类器官是通过干细胞的自我组织形成的三维细胞簇,能够高度模拟原生组织的结构和功能,展现出显著的再生潜力和免疫兼容性,但仍然面临技术复杂、成本高、难以标准化等问题。
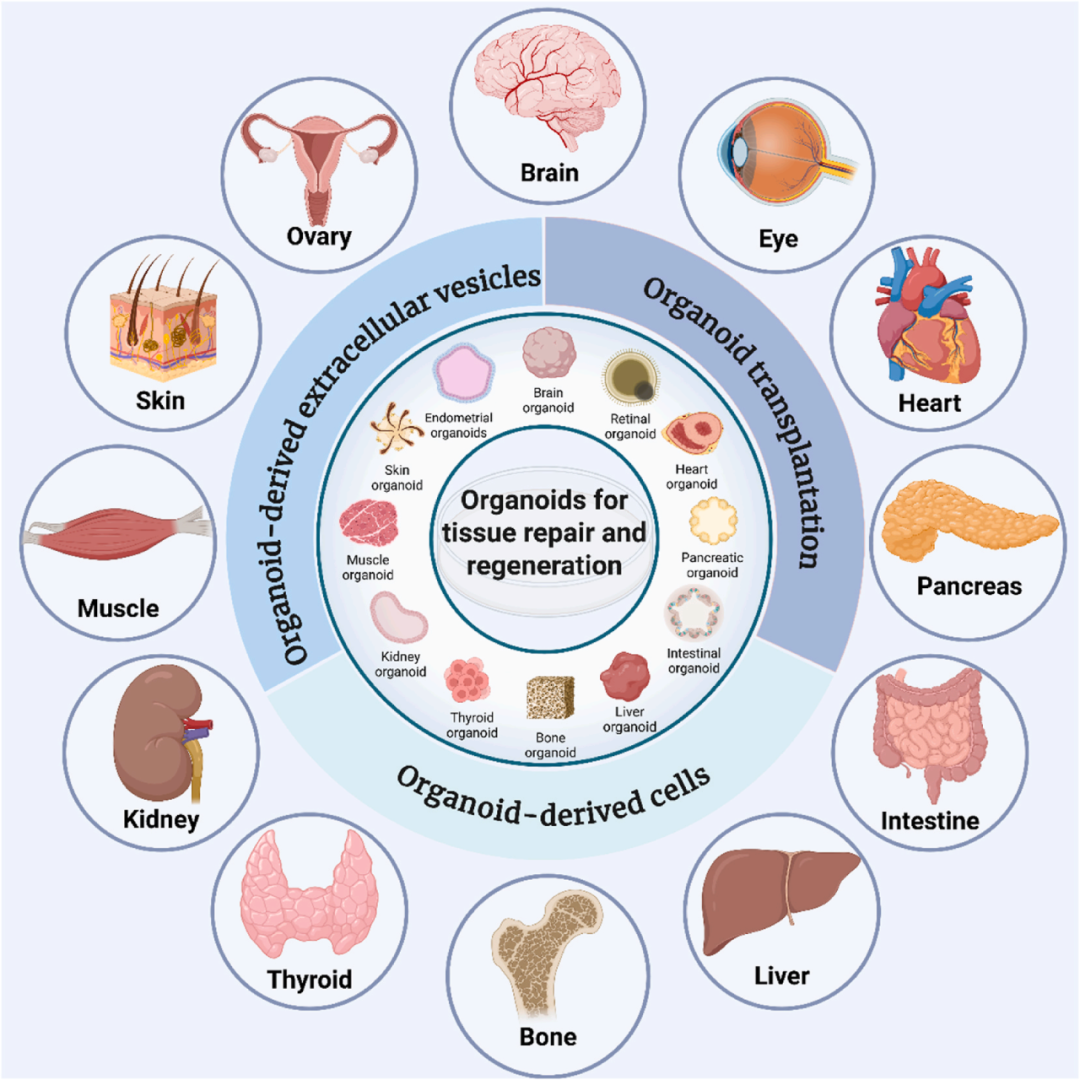
本综述旨在全面探讨类器官在组织修复中的应用,包括其生物学原理、培养策略以及在多种组织(如脑、肝、肠、骨等)中的具体应用和临床前研究进展。
此外,文章还讨论了类器官技术当前面临的挑战,如大规模生产、异质性控制和临床转化等问题,并展望了未来的发展方向。通过优化类器官的培养方法和应用策略,有望克服传统治疗的局限性,为组织修复和再生医学提供更有效的解决方案。
类器官概述
1.1 类器官的生物学基础
类器官通常由胚胎干细胞(ESC)、诱导多能干细胞(iPSC)或成体干细胞(ASC)在三维环境中自组织而成。
ESC和iPSC具有高度多能性,可通过Wnt、BMP等信号诱导生成肝、肠、神经等类器官,但iPSC来源更伦理友好却存畸胎瘤风险。
ASC如间充质干细胞和肠干细胞潜能有限,但构建更快、更成熟,可直接形成骨、软骨或肠绒毛状结构,利于组织修复。三维支架、水凝胶及细胞外基质共同促进细胞分化和功能成熟(图1-2)。
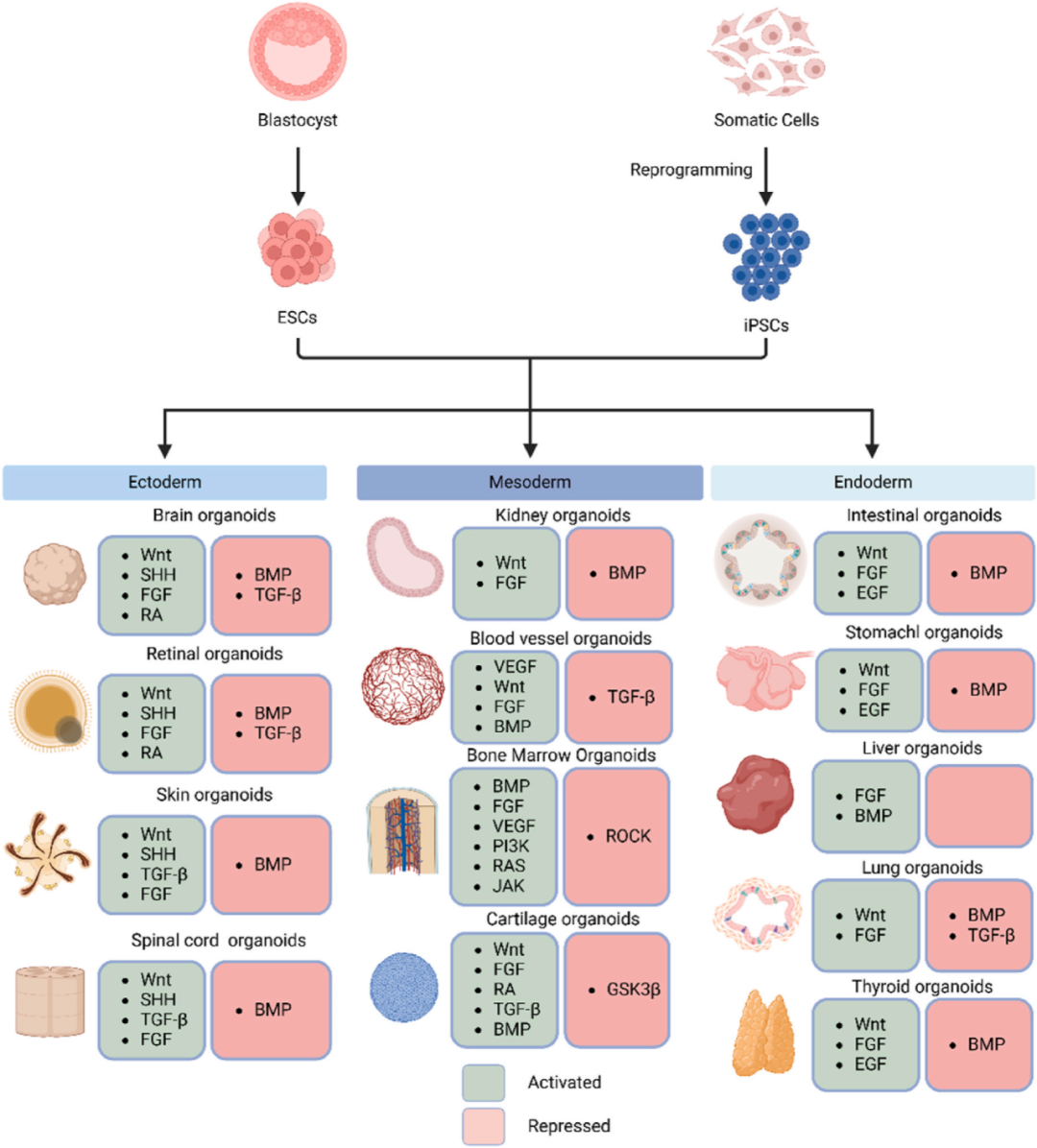
图1 通过激活或抑制适当的信号通路将多能干细胞分化为不同的类器官。多能干细胞包括源自早期胚胎的ESC和通过体细胞重编程获得的iPSC。上图列出了研究中不同类器官构建中被激活或抑制的信号通路,绿色代表激活,红色代表抑制。
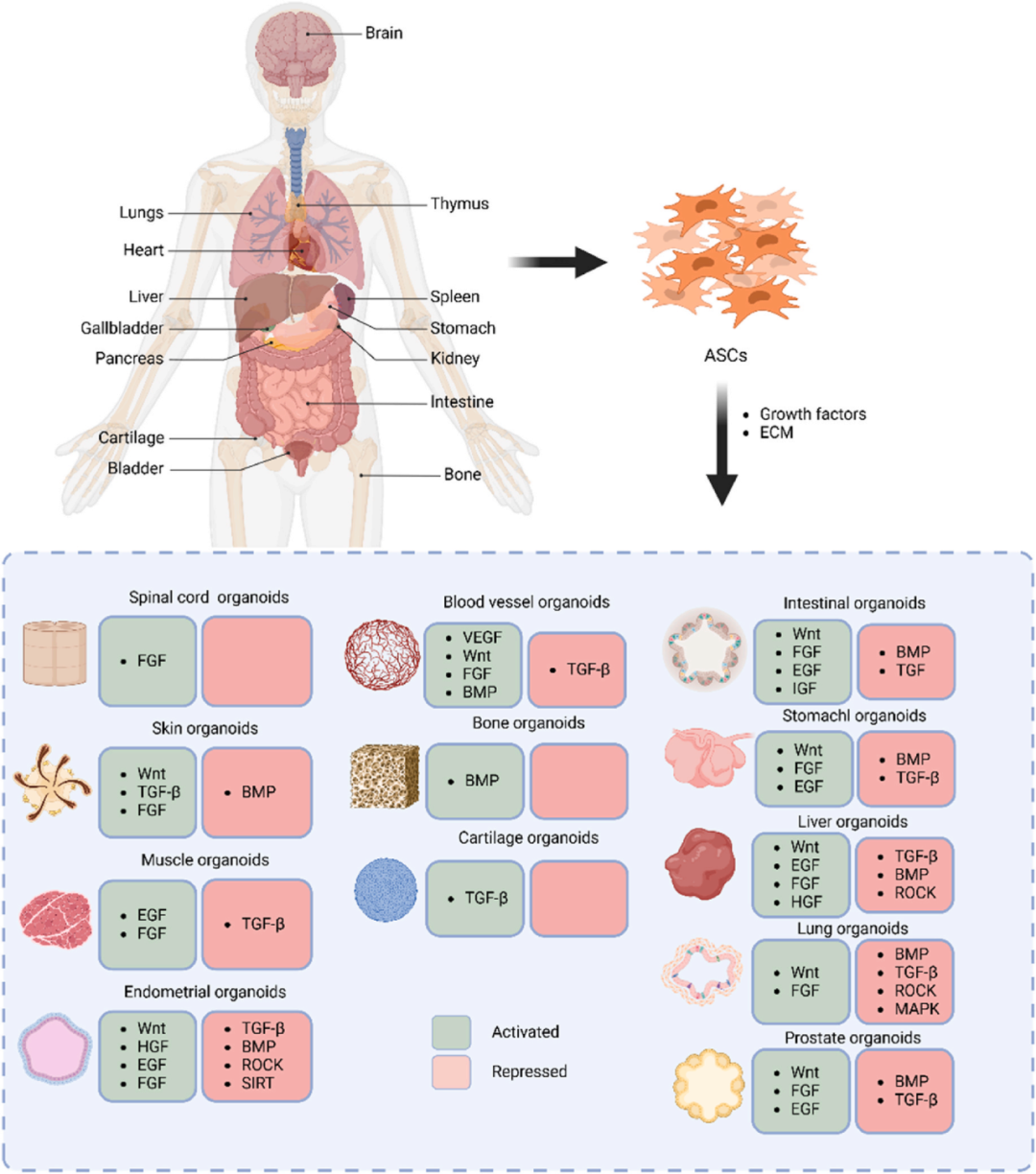
图2 通过激活或抑制适当的信号通路将ASC分化为不同的类器官。ASC起源于各种器官或组织。由于它们的干性有限,它们只能根据合适底物上适当信号通路的激活或抑制分化成相应的类器官。上图列出了研究中被激活或抑制的信号通路,以构建不同的类器官,绿色代表激活,红色代表抑制。
1.2 类器官培养策略
类器官技术借助微孔阵列、生物反应器、微流控、水凝胶及生物打印等工程手段,可在体外精准模拟天然微环境,实现细胞三维自组织与功能成熟。
微孔阵列控制细胞排布,生物反应器供氧养,微流控实现多器官互联,水凝胶提供可调ECM,生物/4D打印塑造复杂结构。
这些技术协同提升类器官的一致性和可扩展性,为组织修复、疾病建模和个性化医疗提供高效平台,但仍需自动化与血管化突破以推进临床转化(图3)。
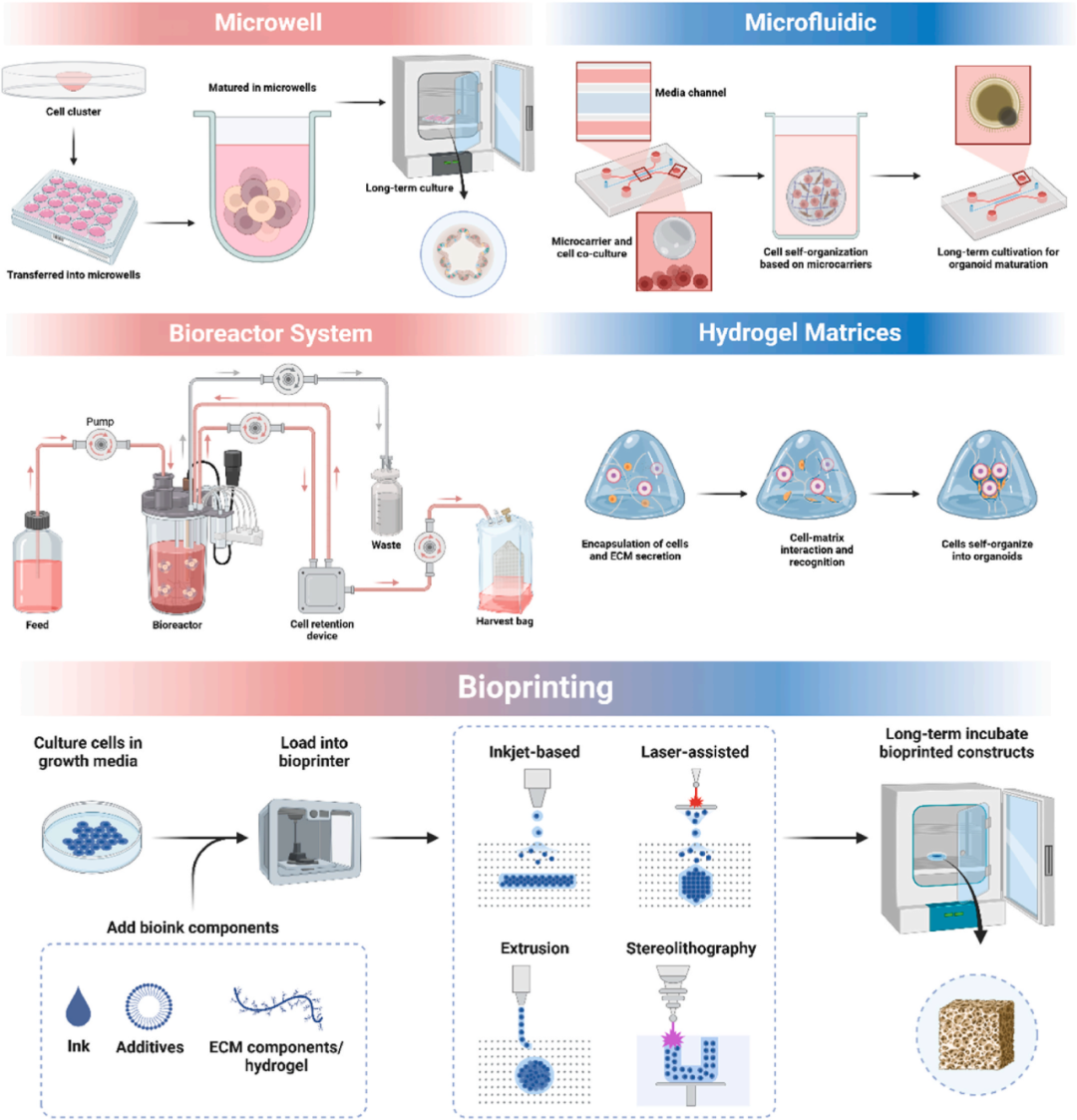
图3 类器官成熟的培养策略。微孔阵列技术、微流控系统、生物反应器系统、水凝胶基质和生物打印技术可以模拟体内的微环境,为类器官的发育、成熟和功能提供理想的支持,从而产生成熟度更高的类器官。
2. 类器官移植用于组织修复
2.1 类器官用于脑组织修复
脑类器官三维模型可高度仿真大脑,正成为脑损伤、卒中与神经退行性疾病修复的革命平台。
外伤性脑损伤中,类器官移植能补充神经元并分泌营养因子,激活内源性修复;Chen等人证实80天皮质类器官可在宿主视觉皮层存活82%,恢复光刺激反应;Ming等人用低强度超声促成熟,结合脑机接口(OBCI)闭环刺激,加速整合。
卒中方面,Cao与Wang将类器官植入缺血模型,6-24小时内移植即可缩小梗死、重建轴突与突触,改善运动感觉功能。帕金森病中,Zheng等人将第15天中脑类器官(hMO)移植小鼠,存活、分化并与宿主双向连接,显著恢复运动功能且无肿瘤(图4-5)。
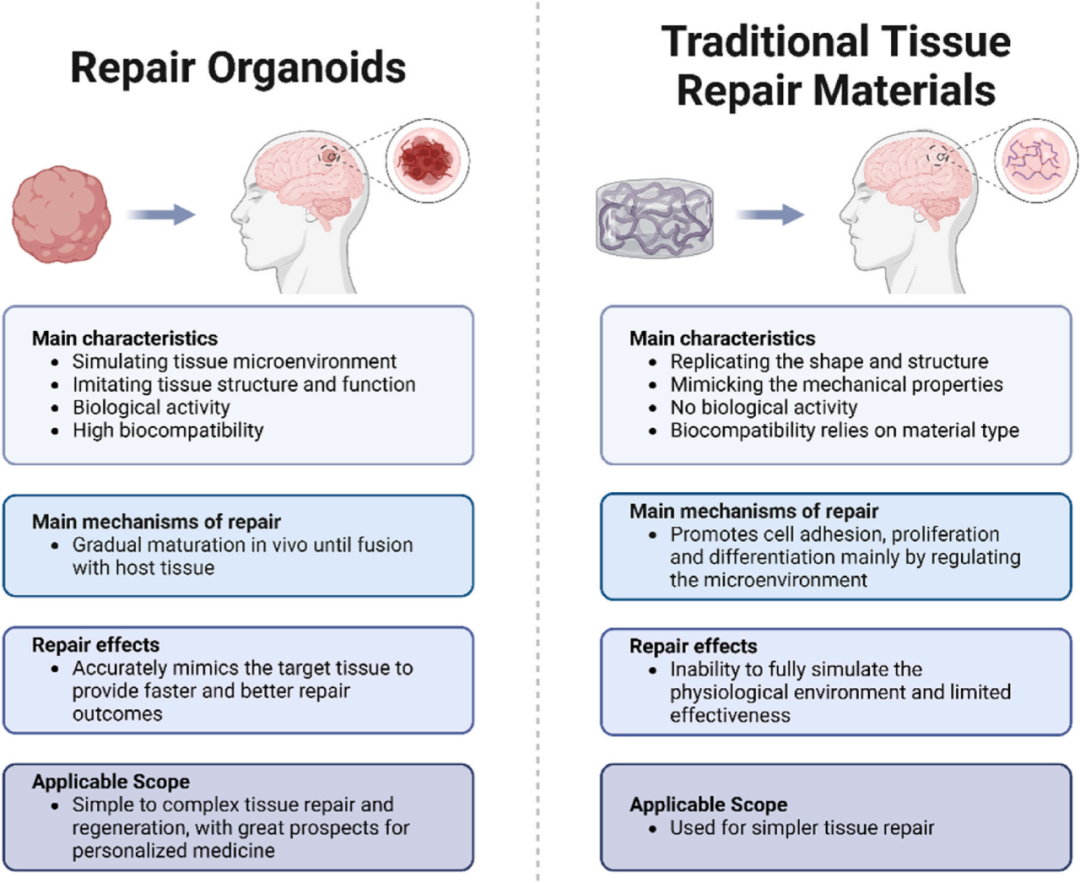
图4 类器官相对于传统组织修复材料的优势。与传统的组织修复材料主要依靠自身特性调节细胞行为以促进组织修复相比,类器官是在体内逐渐成熟并与宿主组织融合的活性微组织,表现出快速有效的特性。
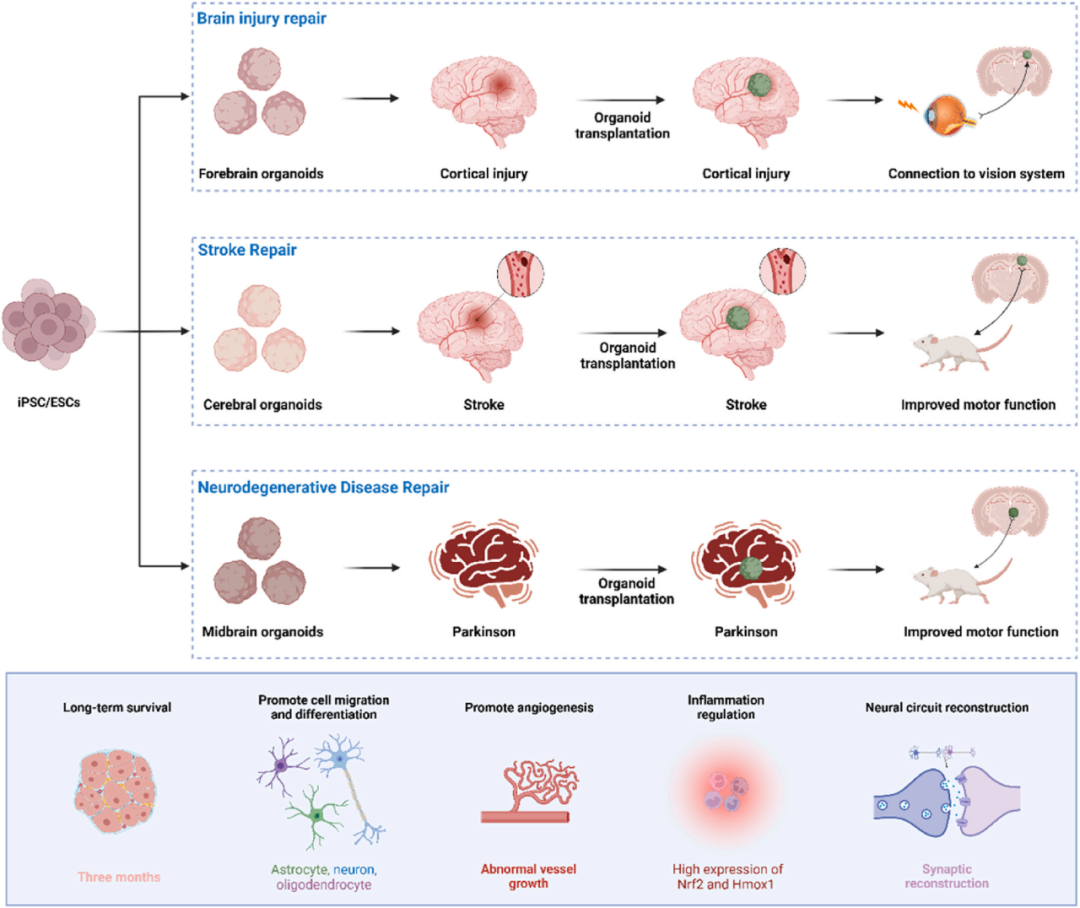
图5 用于脑组织修复的类器官。基于iPSC/ESC的诱导和培养现在可用于构建各种脑类器官,如前脑类器官、脑类器官和中脑类器官,用于治疗脑损伤、中风和神经退行性疾病。这些类器官可以在体内长期存活,其中一些表现出免疫调节能力。随着它们经历细胞迁移、分化和血管化,它们逐渐成熟并最终与脑组织整合,重建神经回路以改善视觉和运动功能。
2.2 类器官用于脊髓组织修复
类器官凭借高度仿生结构,已广泛用于脊髓修复。
Lai等人制备灰白质混合脊髓类器官,小鼠移植后运动功能显著恢复,髓鞘再生与神经支配扩张效果良好;Wang等人的研究显示,人中枢类器官优于微球,能在大范围损伤中促进再生;Xu等人则将星形胶质细胞重编程为脊髓背腹侧神经元,构建双侧功能类器官,移植后与宿主形成突触并恢复运动。
综上,类器官在脊髓损伤中展现神经再生、髓鞘修复和网络重建潜力,具备临床前景。
2.3 类器官用于视网膜组织修复
视网膜类器官移植正成为治疗视网膜变性的新热点。Takahashi团队先后证明,小鼠及人ESC/iPSC来源的视网膜片可在晚期变性模型中重建含内外节段的完整外核层,并与宿主形成突触。
随后,人ESC/iPSC视网膜在裸鼠、大鼠和猴模型中均成功成熟:光感受器存活5个月至2年以上,大鼠出现RGC光反应,猴亦恢复部分光感。
多源干细胞视网膜类器官兼具结构仿真与功能修复潜力,为临床应用奠定坚实基础。
2.4 类器官用于心脏组织修复
三维心脏类器官突破传统二维培养局限,可自发收缩并促进心肌成熟与血管新生。
Vazideh等人利用心脏祖细胞、内皮及间充质干细胞构建3D类器官,实现同步搏动与成体样表型;Mendjan/Lee团队通过序贯激活发育信号,诱导hPSC自组织成无支架、可跳动的腔室状心脏结构,在损伤模型中主动修复。Yu等人将导电硅纳米线植入多细胞心脏类器官,显著增强电活动与缺血耐受,加速梗死区血管生成与功能恢复。
综上,3D心脏类器官兼具结构仿真、电生理整合及再生潜力,为心脏疾病的精准治疗开辟新径。
2.5 类器官用于肝组织修复
干细胞肝类器官为急、慢性肝损伤及胆道疾病带来新疗法。
Tsuchida将胎鼠肝类器官植入慢性损伤大鼠,重建肝细胞与胆管,减轻瘤前病变;Li的hPSC-HBO兼具肝胆谱系,逆转肝窦毛细血管化、抗纤维化;Taniguchi融合数百人iPSC-肝芽,形成可血管化的大体积类器官,显著改善小鼠肝纤维化。
Nie用单供者脐带血+内胚层构建肝类器官,迅速挽救急性肝衰小鼠。Sampaziotis以人胆管细胞培养出ECO,在小鼠及常温灌注人肝内均成功重建胆管并恢复胆汁流动,首次证实类器官可安全、有效移植人体(图6)。
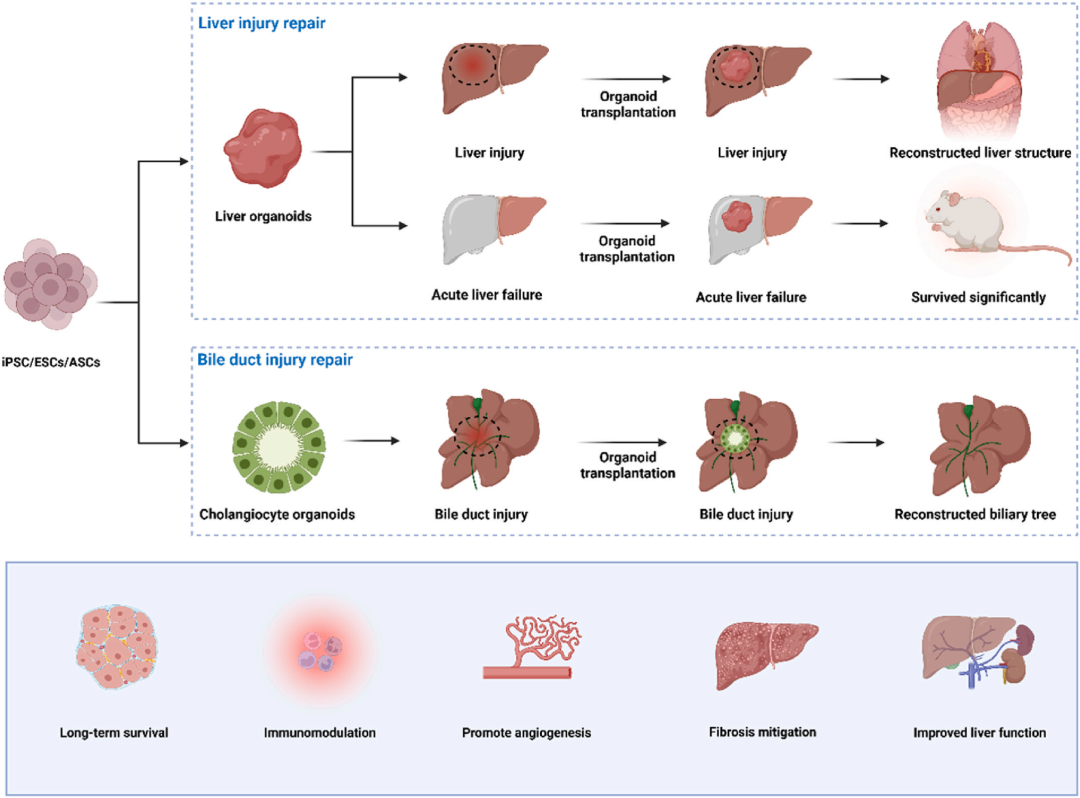
图6 用于肝组织修复的类器官。现在可以通过基于iPSC/ESC/ASC的诱导培养产生肝脏类器官和胆管细胞类器官,用于治疗肝损伤、急性肝衰竭和胆管损伤。这些类器官在体内表现出长期存活,通过细胞迁移、分化和血管化逐渐成熟,与宿主组织整合。有些表现出免疫调节能力并减轻肝纤维化,重建胆管网络和肝脏结构,从而改善肝功能并显著提高动物存活率。
2.6 类器官用于肠组织修复
肠道类器官由PSC或Lgr5+干细胞培养而成,可再现隐窝-绒毛结构。通过调Wnt/BMP/Notch信号,结肠类器官能在小鼠结肠长期定植并修复损伤;Lgr5+直肠类器官可缓解放疗直肠炎;TGFB1预处理则增强再生状态与移植效率。
hPSC来源的HIO碎片化后更易定植小肠各层,恢复完整屏障与离子转运功能。原位注射结肠类器官可重建结肠炎及放射性直肠炎的受损上皮,内镜证实疗效显著(图7)。
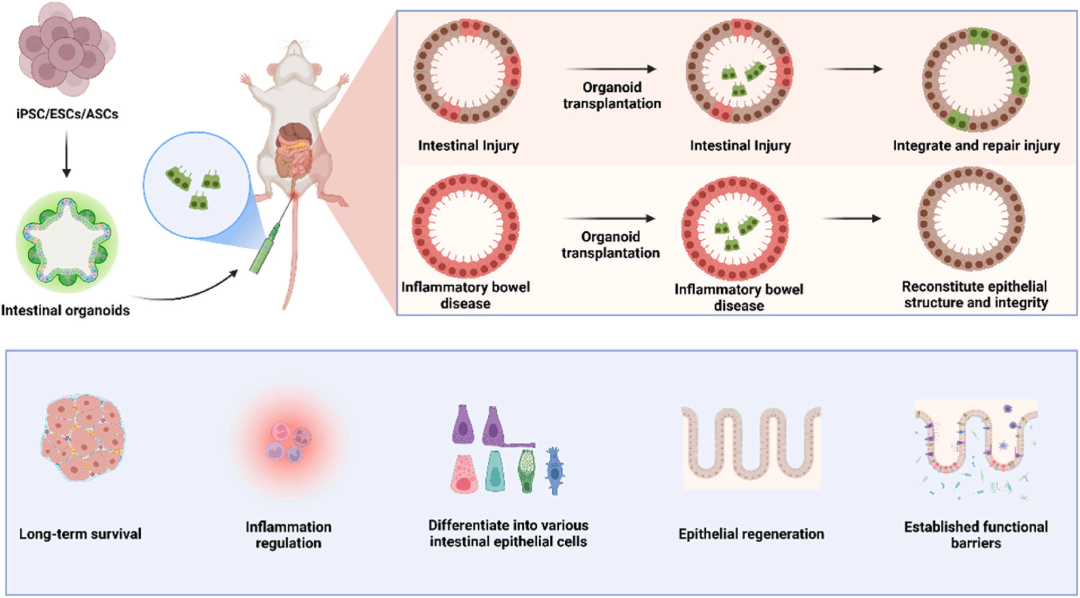
图7 用于肠道组织修复的类器官。肠道类器官已通过定向分化成功地从iPSC/ESC/ASC生成,用于治疗肠道损伤和炎症性肠病。这些类器官通常以碎片形式移植,能够在受伤部位进行靶向定植,同时表现出免疫调节特性。移植的类器官在体内表现出长期存活,通过细胞分化逐渐成熟,与宿主组织整合。在此过程中,它们促进肠上皮再生以促进组织修复,最终重建肠上皮并恢复功能屏障完整性。
2.7 类器官用于骨/软骨组织修复
类器官技术为骨/软骨修复带来新希望:软骨类器官可重建关节软骨,骨软骨类器官同步修复骨与软骨。
iPSC、MSC或软骨祖细胞经3D培养生成富含II型胶原与糖胺聚糖的软骨类器官,已在灵长类关节缺损中安全整合并促进修复;针对OA衰老,靶向miR-24的SMSCs类器官水凝胶显著延缓退变。
骨缺损则借发育启发的软骨内矿化或自矿化骨类器官快速修复:hPSC诱导的软骨类器官经IL-1 预处理可桥接长骨缺损;hPDC构建的 类骨痂 模拟骨折愈合并打印成复杂植入物;DLP打印含GelMA/AlgMA/HAP的自矿化骨类器官4周内完成大段骨再生。动态双网络水凝胶可培养成熟编织骨类器官,体内整合良好。
此外,BMP-2诱导骨膜样组织结合硫酸软骨素增强老年骨再生。类器官为骨/软骨临床修复提供可预测、可扩展的新策略(图8)。
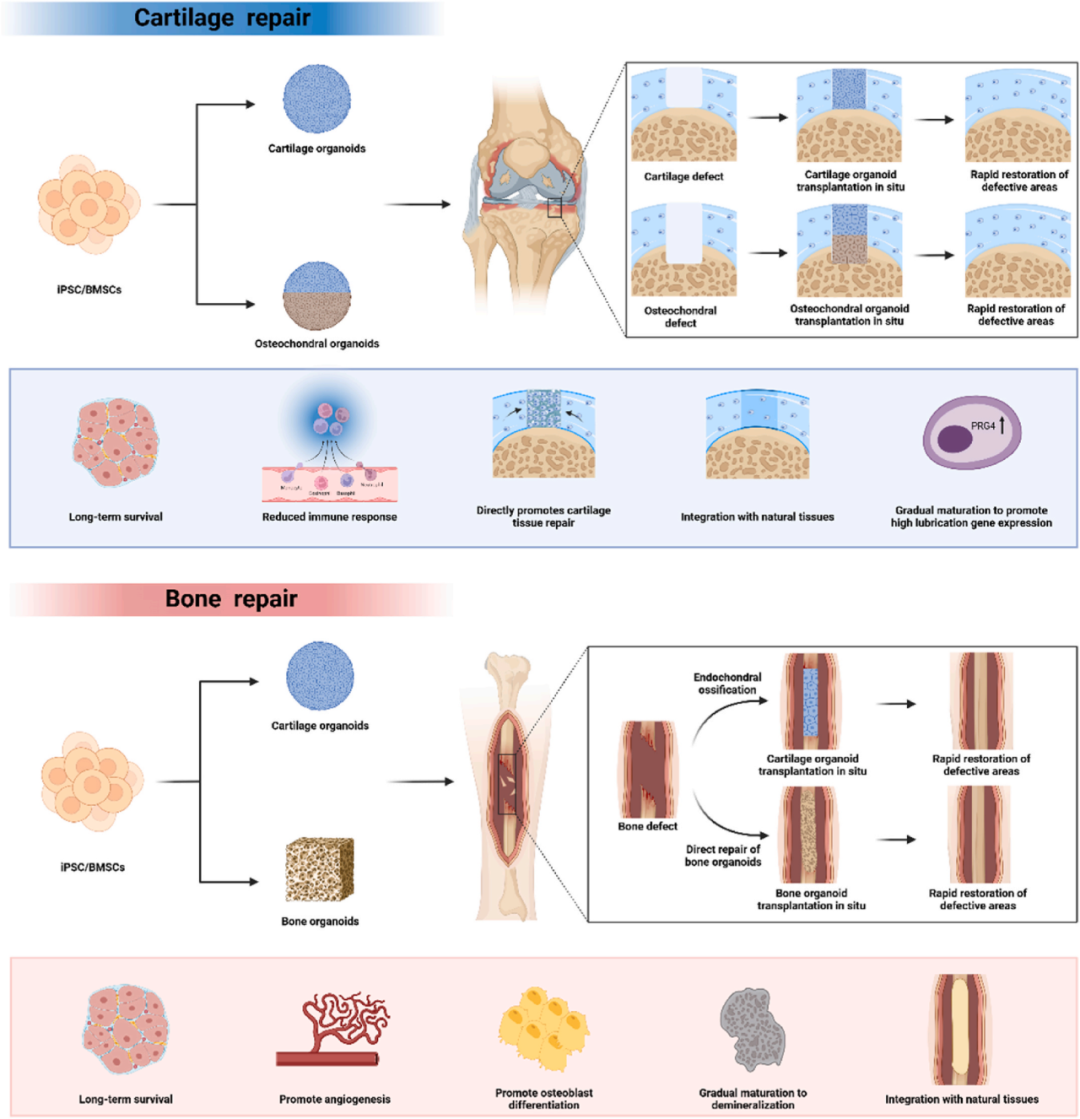
图8 用于骨/软骨组织修复的类器官。通过基于iPSC/BMSC的诱导培养,软骨类器官、骨类器官和整合骨软骨类器官已成功生成,用于修复软骨和骨缺损。对于软骨修复,软骨类器官和整合骨软骨类器官都表现出低免疫原性,通常原位移植到缺损部位。一些表现出滑膜基因表达上调,整合的骨软骨类器官能够同时修复软骨和软骨下骨。骨修复可以通过使用软骨类器官的软骨内矿化策略或通过使用预矿化骨类器官的直接修复来实现。所有移植的类器官在体内都显示出长期存活,通过细胞分化逐渐成熟以与宿主组织整合,从而实现快速骨/软骨缺损再生。
2.8 类器官用于皮肤组织修复
皮肤类器官由角质形成细胞、成纤维细胞和内皮细胞组成,可模拟表皮-真皮结构并重建血管、毛囊与汗腺。
Zhang团队用3D生物打印类器官加速大面积缺损愈合;Wang等将hiPSC-类器官与明胶水凝胶用于冻伤,减少瘢痕;Ma的EM类器官缓解硬皮病并促汗腺血管再生。Choudhury构建过表达Cxcr2的MSC类器官,显著改善糖尿病慢性创面。
Lee用hPSC诱导毛囊-色素皮肤类器官,移植后形成有毛皮肤。机械拉伸或拔毛可借助Piezo1/CCL2信号增强毛囊再生。Diao与Sun分别开发汗腺类器官(SGO/iSwGO),在大面积烧伤后恢复排汗与体温调节。
类器官技术为皮肤、毛发及汗腺损伤的精准再生提供全新策略(图9)。
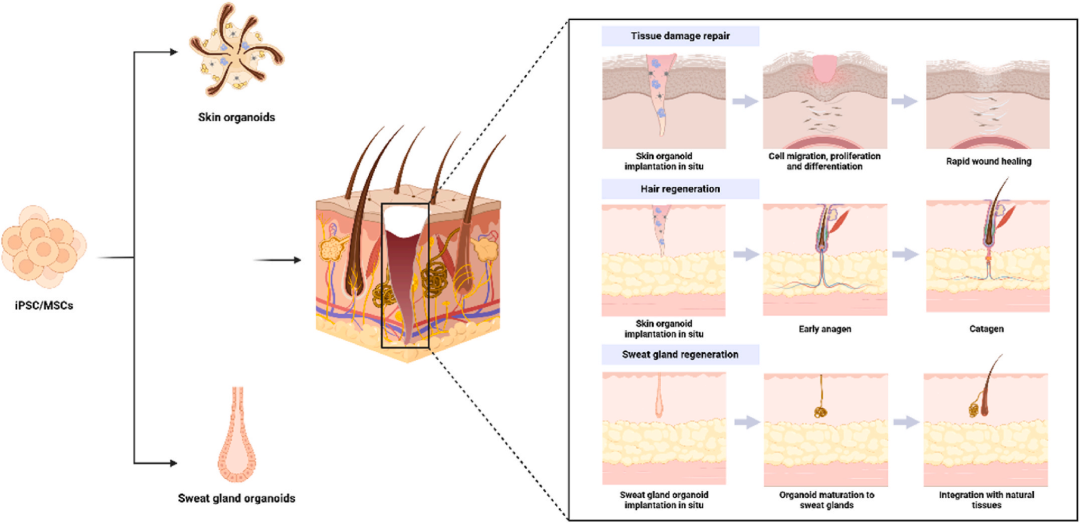
图9 用于皮肤组织修复的类器官。通过基于iPSC/MSC的诱导培养,已成功生成皮肤类器官和汗腺类器官,用于皮肤伤口修复以及头发和汗腺再生。皮肤类器官被原位移植到缺陷部位,在那里它们在体内表现出长期存活。通过渐进的细胞分化和成熟,它们与宿主组织融合,实现皮肤创面的快速再生。
2.9 类器官用于其他组织修复
类器官已在血管、肾脏、肌肉、牙齿及多种腺体中展现修复潜力。
血管类器官可在糖尿病和缺血模型中快速重建灌注网络;肾脏类器官植入大鼠后恢复管状重吸收并重建肾小球血管。
骨骼肌类器官移植显著促进成年小鼠肌肉再生。牙齿类器官分泌矿化基质,实现牙釉质样结构再生。子宫内膜类器官修复Asherman综合征,恢复子宫代谢与生育力。
甲状腺、胸腺和胰岛类器官分别重建激素分泌、T细胞发育和血糖调控,为内分泌功能衰竭提供新策略。
3. 类器官来源细胞(ODC)用于组织修复
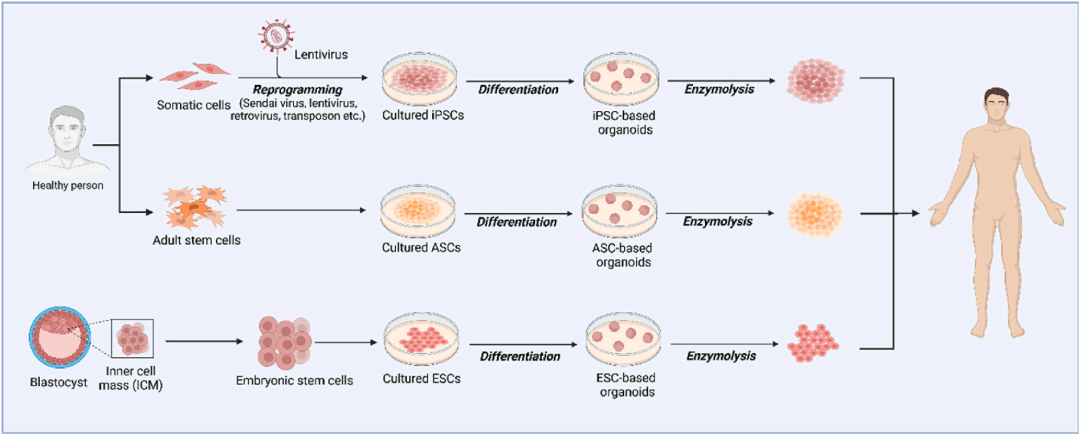
图10 用于组织修复的类器官衍生细胞。类器官来源细胞的分离包括三个关键步骤:a.多能干细胞(包括iPSC/ASC/ESC)的获取;b.类器官的定向诱导和培养;c.酶消化。
3.1 ODC用于视网膜损伤修复
视网膜损伤修复关键在于感光与信号通路的重建。Ader团队以hiPSC衍生的绿色荧光标记视网膜类器官,纯化光感受器移植至视锥细胞缺失小鼠后,细胞成功整合并恢复感光功能。
He等用表达GCaMP5的C-Kit+RPC类器官治疗晚期退行性病,细胞迁移并分化为多种神经元,形成功能突触网络,显著延缓视力丧失;Luo等将hiPSC-RGC类器官加载于可降解PLGA支架,移植后细胞存活、迁移并呈现电生理活性,冷冻复苏的类器官亦保持功能。
3.2 ODC用于肺损伤修复
肺类器官由干细胞自组装而成,可分化为I、II型肺泡与气道细胞。移植实验表明,人肺类器官可在小鼠体内成熟并重建血管、神经网络;AT2类器官在流感模型中恢复肺泡上皮,提高氧饱和度。
气道类器官及Bud Tip细胞亦能长期存活、增殖并分化为多种上皮细胞,修复受损气道而支持肺再生,为肺损伤的细胞治疗提供实验依据与新策略。
3.3 ODC用于肝损伤修复
慢性肝炎、肝纤维化等长期损伤可致肝功能衰竭或肝癌。Peng团队利用EpCAM⁺Gli1⁺双表型细胞构建的肝类器官,可在FRG小鼠肝脏定植并显著降低肝酶,改善功能。
Liu等发现软骨内成骨期MSC亦能减轻四氯化碳诱导的肝纤维化。随着干细胞与类器官技术成熟,其衍生细胞有望为肝损伤修复提供安全高效的新范式。
3.4 ODC用于肌肉再生
骨骼肌疾病涵盖遗传、获得及代谢性肌病,传统疗法受限于卫星细胞不足。Lee团队以三维类器官技术,从成人肌组织中高效扩增体外衍生卫星细胞(idSC),构建骨骼肌类器官(SkMO)。移植小鼠后,idSC可融合肌纤维、自我更新并支持多次修复,为肌病细胞治疗提供足量干细胞来源与实验依据。
4. 类器官来源的细胞外囊泡(OEV)用于组织修复
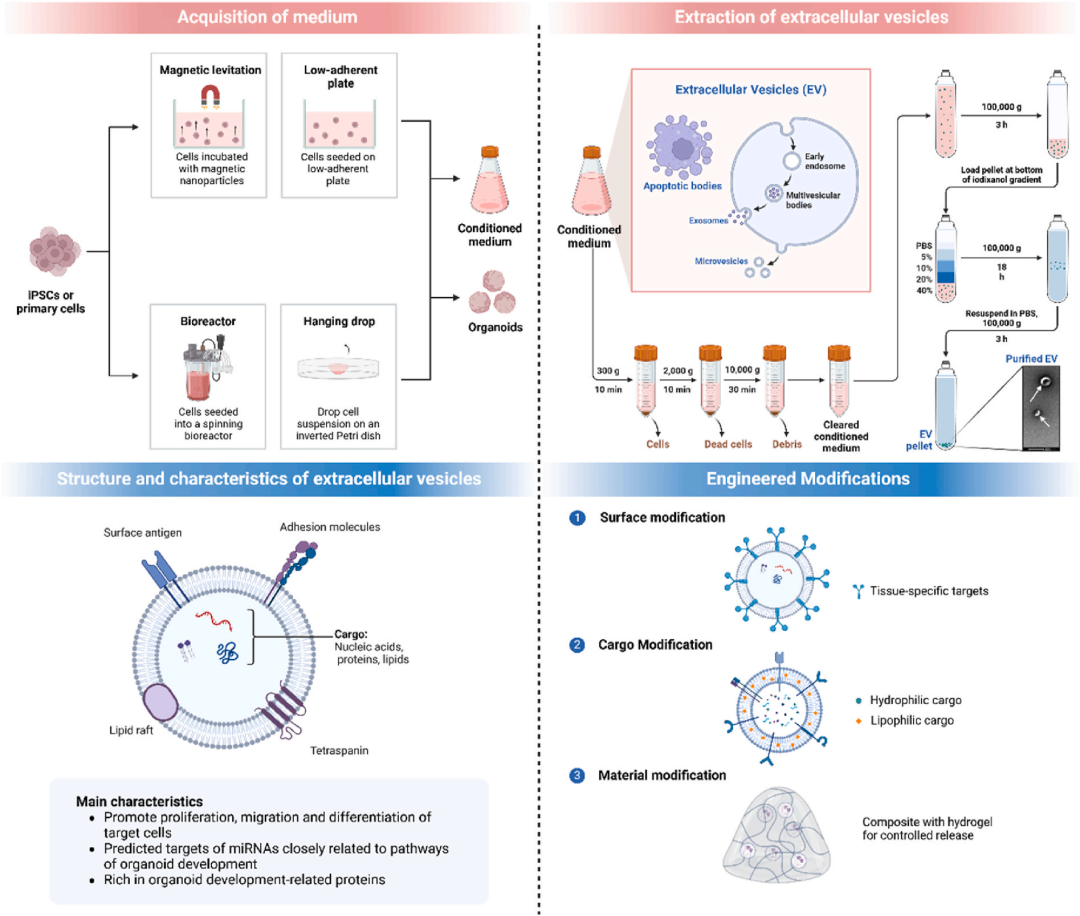
图11 用于组织修复的类器官衍生的细胞外囊泡(OEV)。OEV是通过收集的培养基梯度离心等方法获得的。这些OEV含有丰富的蛋白质和miRNA,可促进器官发育,促进细胞增殖、迁移和分化,从而增强组织修复。此外,工程修饰可以赋予OEV靶向组织归巢、货物装载和缓释能力。
4.1 OEV用于皮肤修复
OEV为皮肤修复带来新希望。Kwak团队从表皮类器官(iEpiO)提取的OEV富含VEGF与miRNA,可在体外促进细胞增殖、迁移与血管形成,并显著加速小鼠创面愈合。
Qian等将人小涎腺类器官外泌体(MsOrg-Exo)载入GelMA水凝胶,构建慢性伤口控释系统,显著提升胶原合成、血管生成和细胞增殖,并通过诱导巨噬细胞从M1向M2极化,改善炎症微环境,加速愈合。
4.2 OEV用于视网膜修复
视网膜发育受内外信号精细调控,促使祖细胞分化为节细胞、视锥、水平、无突、双极、杆及M ller细胞等亚型。Zhou等发现,视网膜类器官释放的OEV可被hiPSC-RPC摄取,通过miRNA等sncRNA调控核转运、转录及神经节细胞和光感受器分化,且其表达时序与人类视网膜发育同步。
Gao团队用hERO-RPC-EV治疗脂质超载RPE损伤,体外减少脂毒与氧化应激,体内保护RPE并减轻病变;蛋白组学显示其富含免疫与视网膜发育相关蛋白。
Huang等进一步证实,hERO-RPC-sEV能被M ller细胞摄取,经miRNA下调NFIB抑制其胶质瘤转分化,在RCS大鼠中保护视网膜结构与功能。
综上,视网膜类器官来源的细胞外囊泡为无细胞治疗视网膜退行性疾病提供了新策略,也为基于sEV的药物开发指明方向。
4.3 OEV用于子宫内膜修复
子宫内膜类器官释放的细胞外囊泡(EV)携带miRNA等活性分子,可调控受体细胞,减少纤维化、促进血管新生并提升子宫内膜容受性,为阿什曼综合征等损伤修复带来新思路。
Qin团队将人子宫内膜类器官EV与肽两亲水凝胶(CPA)结合,制成可喷雾的CPA@HEO-EV。该复合水凝胶兼具EV再生潜能与CPA的粘附、抗氧化特性,体外可显著促进细胞增殖、清除自由基并诱导血管生成;体内实验显示其有效防止子宫内膜纤维化并恢复生育能力,为不孕症治疗提供创新、便捷的临床策略。
5. 类器官临床应用的挑战与展望
5.1 类器官临床应用中的挑战
类器官虽展示了组织修复的革命潜力,但临床转化仍受多重瓶颈制约:血管与神经网络缺失导致移植后氧供不足、整合受限;结构简单、功能不全难以应对中晚期复杂病变;体外扩增周期长、工艺复杂,难以快速满足急性需求。
动物验证需解决免疫健全模型中的血管化、长期安全性及人病模拟不足;伦理监管尚缺统一分类与供体同意规范;GMP层面则面临自动化封闭生产、昂贵原料、批次均质性及无损质控等挑战。只有跨越这些技术、免疫与伦理壁垒,类器官才能真正走向临床。
5.2 类器官临床应用展望
医药网新闻
- 相关报道
-
- Nature子刊:浙江大学方向前/赵玥绮/唐睿康/刘昭明团队开发抗衰老的时空自适应纳米疗法 (2025-10-07)
- Neuron:大脑“超清摄像头”问世!神经观测有望进入新时代 (2025-10-07)
- 科研人员绘制图谱解析风险SNP驱动的促肿瘤机制 (2025-10-06)
- Nature子刊:邓攀团队提出AI框架——CellNavi,为细胞研究装上“导航仪” (2025-10-06)
- Nature头条:如何才能科学地睡个好觉?做到这三点至关重要 (2025-10-05)
- 中国科学院最新论文,登上Science封面 (2025-10-05)
- 《细胞》子刊:微生物守护卵巢健康!科学家发现,雌性小鼠生育年龄与微生物有关,微生物代谢物可防止卵巢储备加速流失 (2025-10-04)
- 珍·古道尔的遗产:她改变科学的三种方式 (2025-10-04)
- Nature Aging:沈舒滢/季明亮/赵兴团队发现骨关节炎治疗新靶点,并提出基于LNP-mRNA的新疗法 (2025-10-03)
- Nature Medicine:颠覆认知!体重不减反增,为何依然能逆转糖尿病前期? (2025-10-03)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















