Cell :Ras、Rho 和 Rab 家族 GTP 酶的靶向药物开发 |
 |

最近,在K-Ras中发现的隐秘变构switch II口袋(SII口袋)推动了针对K-Ras(G12C)突变癌症的治疗药物开发,如LUMAKRAS和Krazati【3】。此外,其他候选药物如GDC6036也在临床试验中取得了良好结果【4】。然而,目前K-Ras的可成药性仍然是一个特殊案例,其他GTP酶是否能够以类似方式被靶向尚不明确。
靶向Ras家族GTP酶
首先,研究人员发现,K-Ras(G12C)抑制剂不仅可以有效靶向K-Ras本身,还能靶向H-Ras(G12C)和N-Ras(G12C)。这些抑制剂通过与SII口袋结合发挥作用,前提是存在合适的配体。同时,他们在a3螺旋上发现了几个关键残基,这些残基与SII口袋中的配体结合密切相关。尽管这些残基在不同小GTP酶中保守性较低,但SII口袋及a3螺旋上的基团对口袋形状和抑制剂的结合至关重要。
研究还发现,一些K-Ras(G12C)抑制剂对N-Ras(G12C)驱动的肿瘤具有潜在的治疗效果。Ras超家族GTP酶及其亚家族的序列存在差异。
实验显示,RalA(G23C)和Rap1A(G12C)在与SII口袋抑制剂的共价结合方面表现出不同的动力学特征。RalA(G23C)与MRTX1257或divarasib结合的速度较快,且具有较高的热稳定性。突变型Rap1A(G12C, L96F)与抑制剂的结合速度显著提高。其他GTP酶如Rit1和M-Ras也能被SII口袋抑制剂有效靶向,但Rheb的靶向效果较差。
为了验证MRTX1257对RalA(G23C)的结合是否类似于对K-Ras(G12C),研究人员分析了RalA(G23C)、GDP和MRTX1257的复合物。结果显示,GDP和MRTX1257的结合显著提高了RalA(G23C)的结构稳定性。进一步研究表明,MRTX1257和divarasib能有效抑制RalA(G23C)和Rap1A(G12C, L96F),并且divarasib与RalA和Rap1A的结合是可逆的,这表明开发靶向GTP酶的可逆抑制剂是可行的。
此外,研究还考察了一种新型三联体抑制剂(包括K-Ras(G12C)、化学配体和亲环蛋白A(CypA))。通过对新配体RMC-4998的晶体结构分析,发现K-Ras的关键残基可以与CypA形成氢键,促进配体结合。进一步研究表明,RMC-6291能够有效靶向其他具有高度序列同源性的Ras家族GTP酶。
靶向其他GTP酶
接下来,研究人员探讨了K-Ras(G12C)抑制剂通过SII口袋靶向Rho和Rab家族GTP酶的潜力。结果显示,尽管RhoA和Rac1,以及Rab1A和Rab5C的靶向效果不错,但与Ras家族GTP酶相比,这些抑制剂在Rho和Rab家族中的效果较差,这可能与 3螺旋上的残基差异有关。特别是,divarasib对Rac1(G12C)的靶向较为迅速,但SII口袋中特定残基的变异显著影响了靶向效果。实验还发现,divarasib没有显著提高Rac1的热稳定性,并且其靶向效果受核苷酸状态的影响。此外,MRTX1257和divarasib同样是Rab家族GTP酶Rab1A(S20C)和Rab5C(S30C)的有效共价配体。进一步研究表明,MRTX1257和divarasib能完全靶向Rab1A(S20C),而对Rab5C(S30C)的靶向效果则较差。研究结果还显示,优化后的K-Ras(G12C)配体在靶向Rho和Rab GTP酶方面的效果仍需改进。此外,对双突变体Rac1(G12C, K96H)的功能实验显示,divarasib可以有效减少Rac1与PAK1的结合。
GTP酶抑制剂的开发
最后,研究人员利用分子动力学(MD)和量子力学(QM)模拟,设计并测试了22种新化合物,旨在开发靶向不同GTP酶(如Rac1、Rab1A和Rab5C)的选择性配体。通过比较SII口袋的结合构象和标记动力学,他们发现化合物11在Rac1(G12C)和Rab1A(S20C)中的表现优异,其靶向速度约为divarasib的两倍。研究还显示,甲基萘作为C7取代基可以优化对Rab5C(S30C)的靶向速度。此外,不同GTP酶对C2位置取代基的敏感性也有所不同。扩展后的化合物库同样能够有效靶向K-Ras(G12C),显示出进一步开发的潜力。这些发现为设计选择性配体提供了重要的指导。
综上所述,该研究发现GTP酶家族中SII口袋的关键结构是保守的,这使得靶向多种GTP酶成为可能,并为开发GTP酶的可逆抑制剂提供了新的机会。
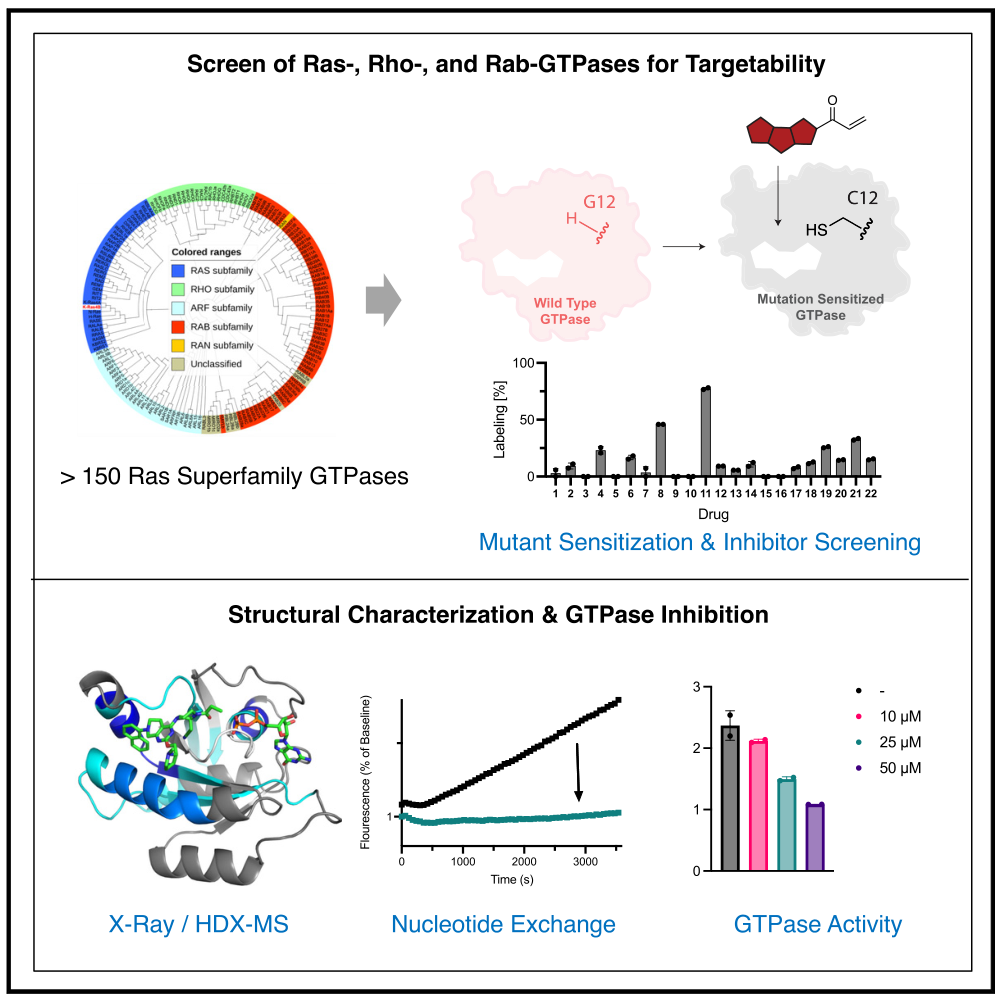
模式图(Credit: Cell)
医药网新闻
- 相关报道
-
- 民泰医药全面升级:2025年搬迁新址,打造中药智能化生产新标杆 (2025-07-11)
- 第一次为爱鼓掌要做好准备!快男备好爱廷玖盐酸达泊西汀 (2025-07-11)
- 《Science》刊发上海六院与复旦大学脑科学转化研究院联合成果:揭示造血干细胞移植治疗致死性遗传性脑白质病的有效性及其核心机制 (2025-07-11)
- 青海首批外乡产3D打印医疗东西获批上市 (2025-07-11)
- 全国药品运营监管任务会暨“清源”行为推动会召开 (2025-07-11)
- 软骨发育不全等86个常见病病种诊疗指南宣布 (2025-07-11)
- 700亿美元并购风暴,制药巨头狂砸CNS赛道的背后 (2025-07-11)
- 乳酸菌竟是心梗救治的隐形卫士?BMC Med研究揭秘:通过多重机制减轻心肌缺血再灌注损伤 (2025-07-11)
- 中国科学院发表最新Cell论文 (2025-07-11)
- 《自然》:“扭断”Tau纤维!UCLA团队发明可自组装短肽,与Tau纤维结合后会释放结构应力,让Tau纤维断裂成无毒碎片 (2025-07-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















