汇宇制药3大注射剂领跑过评榜 4+7品种销售暴涨325倍 |
 |
医药网4月16日讯 日前,四川汇宇制药以仿制4类申报的注射用硼替佐米、盐酸帕洛诺司琼注射液上市申请获得CDE承办受理,至今公司已有11个注射剂以新注册分类报产,其中6个在欧盟获批上市,转报国内并纳入/拟纳入优先审评,此外还有3个欧盟上市注射剂待转报国内。11个注射剂中有3个获批生产并视同过评,培美曲塞为首批4+7品种,借助独家中标优势,汇宇制药市场份额激增;在审的8大注射剂中,汇宇制药的普乐沙福注射液有望以首仿+过评获批上市。
比肩恒瑞、中生,3大品种领跑注射剂过评榜
图:过评注射剂品种数达2个及以上的企业(以集团计)
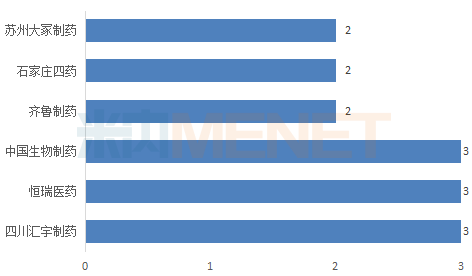
米内网数据显示,目前有企业通过或视同通过一致性评价的注射剂有46个受理号(以药品名称计,共30个品种),涉及26家企业(以集团计),其中有6家企业过评注射剂品种数达2个及以上,汇宇制药、恒瑞医药、中国生物制药以3个过评品种并列榜首,涉及的受理号分别为7个、3个、3个。
表1:汇宇制药已过评品种
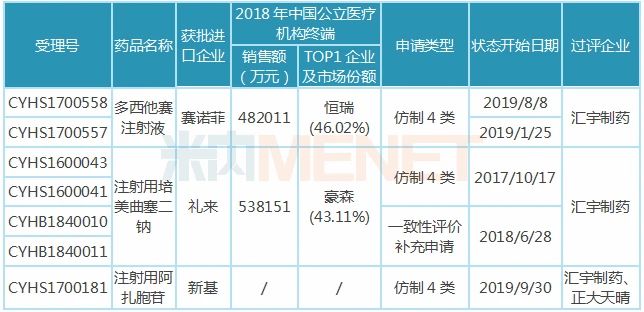
汇宇制药已过评的3款注射剂均为抗肿瘤药,米内网数据显示,2018年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端抗肿瘤化药产品竞争格局中,注射用培美曲塞二钠、多西他赛注射液分别以6.77%、6.06%市场份额排位第一、第二。
3款注射剂中,注射用培美曲塞二钠被纳入第一批4+7带量采购,作为该品种唯一过评企业,汇宇制药成功中标。在集采之前,培美曲塞市场主要由豪森、齐鲁及礼来占领,带量采购助力“光脚企业”汇宇制药销量迅速上升,抢占市场份额。
米内网数据显示,2019年重点城市公立医院化学药终端(样本覆盖北京、哈尔滨、长春、沈阳、天津、石家庄、太原、广州、深圳、郑州、重庆、武汉、长沙、上海、济南、杭州、南京、福州、成都、西安20个城市,其中9个为4+7试点城市)注射用培美曲塞二钠厂家竞争格局中,汇宇制药排位第三(销售额同比增长32509.46%),仅次于豪森、齐鲁。凭借独家中标的优势,汇宇制药的市场份额由2018年的0.06%上升至2019年的19.87%。2019年9月开展的4+7扩面集采,汇宇制药与礼来中选,销量有望再上新台阶。
注射用阿扎胞苷过评企业包括汇宇制药及正大天晴,大概率入选第三批国家集采,而多西他赛注射液目前虽仅汇宇制药独家过评,但已有4家药企按仿制4类报产,6家药企提交一致性评价补充申请,不日将诞生第二家过评企业。随着国家带量采购的不断推进,“光脚企业”汇宇制药或将持续受益。
8大注射剂在审,与扬子江、齐鲁等交锋
4月8日、4月10日,四川汇宇制药以仿制4类提交的盐酸帕洛诺司琼注射液、注射用硼替佐米上市申请获得CDE承办受理,至今公司已按新注册分类提交11个注射剂上市申请(3个已获批)。这11个注射剂中,有6个扬子江已布局,齐鲁、正大天晴、恒瑞均布局了5个。
表2:四川汇宇制药新注册分类报产且暂未获批的品种
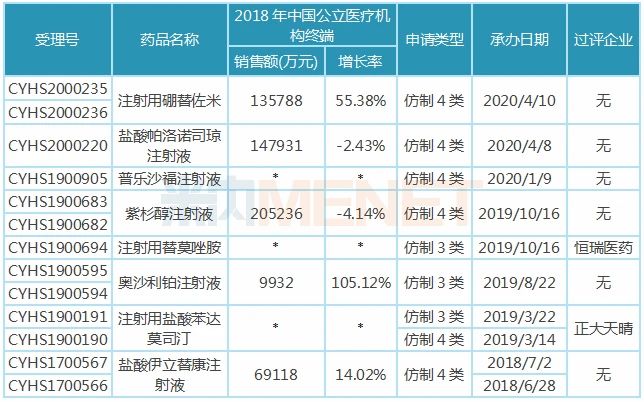
注:销售额低于3000万用符号*代表
在审的8大注射剂中,除了盐酸帕洛诺司琼注射液为止吐止恶心药外,其余7个注射剂均为抗肿瘤药,紫杉醇注射液、注射用硼替佐米年销均超10亿元,在2018年中国公立医疗机构终端抗肿瘤化药产品竞争格局中,分别以2.58%、1.71%排在第16、17位。
注射用替莫唑胺、注射用盐酸苯达莫司汀已有企业过评,恒瑞医药打破了替莫唑胺注射剂型在国内市场的空白局面;正大天晴的注射用盐酸苯达莫司汀以首仿+过评的方式获批上市。
表3:汇宇制药已报产且未有企业过评的品种
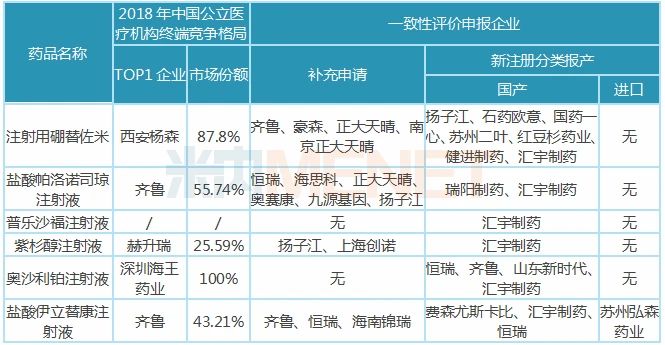
暂无企业过评的6大注射剂中,普乐沙福注射液未有首仿获批,该产品由赛诺菲旗下的健赞制药研发,于2008年12月获得FDA批准上市,2018年12月获批进入国内市场。汇宇制药独家申报,有望以首仿+过评获批上市。
汇宇制药的紫杉醇注射液以新注册分类报产,虽然还有扬子江、上海创诺提交该产品一致性评价补充申请,但汇宇制药的产品由国外转报国内且纳入优先审评,从申报进展看,汇宇制药首家过评的几率还是很大的。
6个注射剂弯道超车,这3个待转报国内
汇宇制药秉承成为国际化制药企业的愿景,历经多年发展,国际化布局卓有成效,2014年成为中国第一家通过英国GMP认证的抗肿瘤注射剂生产企业;2015年成为中国第一家以自主品牌的注射剂在欧美发达国家销售的企业......
目前公司有9个注射剂在欧盟国家获批上市,分别为注射用盐酸苯达莫司汀、多西他赛注射液、盐酸多柔比星注射液、盐酸伊立替康注射液、奥沙利铂注射液、紫杉醇注射液、注射用培美曲塞二钠、唑来膦酸注射液及盐酸表柔比星注射液。
表4:汇宇制药纳入/拟纳入优先审评品种
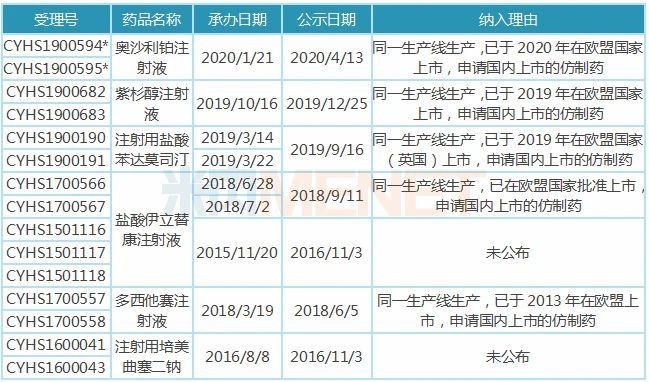
注:带*为拟优先审评
9个注射剂有6个已在国内申报上市,其中5个品种(13个受理号)纳入优先审评,1个品种(2个受理号)拟纳入优先审评,纳入理由为同一生产线生产,已在欧盟国家上市,申请国内上市的仿制药,多西他赛、培美曲塞已顺利获批并视同过评。
表5:汇宇制药已在欧盟上市但未在国内报产的品种

盐酸多柔比星注射液、盐酸表柔比星注射液、唑来膦酸注射液3个品种已在欧盟获批,汇宇制药一旦在国内提交上市申请,将大概率纳入优先审评,实现弯道超车。米内网数据显示,2018年中国公立医疗机构终端多柔比星、表柔比星、唑来膦酸销售额分别为26.85亿元、10.37亿元、20.02亿元。
来源:米内网数据库、公司官网
注:数据统计截至4月15日,如有疏漏,欢迎指正!
医药网新闻
- 相关报道
-
- 对于进一步欠缺医药价钱和招采信誉评估轨制的关照 (2025-06-06)
- 首个国产九价HPV疫苗获批上市 (2025-06-05)
- 辅助生殖用度怎样报销?——海南省辅助生殖报销政策 (2025-06-05)
- 本年11月尾前完成全国三级公立西医院儿科设置全笼罩 (2025-06-04)
- 对于医防管穿插复合型策略人才步队建设倒退的意见 (2025-06-04)
- 再次征求对于增强药品受托临盆监视治理任务的布告 (2025-06-03)
- 药品追溯码入库环节信息采集光阴紧缩至1分钟左右 (2025-06-03)
- 我国已同意宣布儿童相关畛域国度尺度210余项 为儿童安康生长保驾护航 (2025-06-03)
- 山东为儿童筑起安康防地 动静展开疾病筛查和干涉 (2025-05-30)
- 匆匆进窘境儿童安康生长 五部分部署展开主题运动 (2025-05-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















