国产激酶抑制剂!美国FDA授予和黄医药索凡替尼2个快速通道资格,治疗胰腺非胰腺神经内分泌瘤! |
 |

2020年04月19日讯 /BIOON/ --和黄中国医药科技有限公司(简称“和黄医药”或“Chi-Med”)近日宣布,美国食品和药物管理局()已授予索凡替尼(surufatinib,亦称HMPL-012或sulfatinib)2个快速通道资格(Fast Track Designation,FTD),用于治疗:晚期和进行性胰腺神经内分泌(NET)患者,以及不适合手术的胰腺外(非胰腺)NET患者。去年11月,还授予了索凡替尼治疗胰腺NET的孤儿药资格(ODD)。
快速通道资格(FTD)旨在加速针对严重疾病的药物开发和快速审查,以解决关键领域严重未获满足的医疗需求。研究性药物获得快速通道资格,意味着药企在研发阶段可以与进行更频繁的互动,在提交上市申请后如果符合相关标准则有资格进行加速审批和优先审查,此外也有资格进行滚动审查。
索凡替尼是由和黄医药自主研发的一种新型的口服酪氨酸激酶抑制剂,具有抗血管生成和免疫调节双重活性。索凡替尼可通过抑制血管内皮生长因子受体(VEGFR)和成纤维细胞生长因子受体(FGFR)以阻断肿瘤血管生成,并可抑制集落刺激因子-1受体(CSF-1R),通过调节肿瘤相关巨噬细胞,促进机体对肿瘤细胞的免疫应答。因为具有抗血管生成和免疫调节的独特双重作用机制,索凡替尼可能非常适合与其他免疫疗法联合使用。和黄医药目前拥有索凡替尼在全球范围内的所有权利。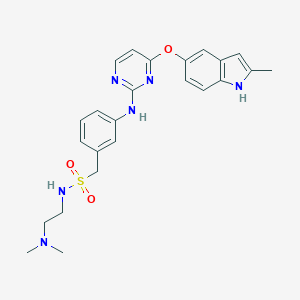
surufatinib分子结构式(图片来源:pubchem)
美国、欧洲、日本神经内分泌(NET)开发项目:目前,和黄医药正在为美国、欧洲、日本的监管互动做准备,以确认临床开发和注册途径,这是基于在中国开展的2项阳性III期临床研究中令人鼓舞的数据,以及正在美国开展的多队列Ib期研究(NCT02549937)。在美国,除了被授予治疗胰腺NET和非胰腺NET的快速通道资格(FTD),索凡替尼还于2019年11月获得了治疗胰腺NET的孤儿药资格(ODD)。
中国非胰腺神经内分泌(NET)开发项目:2019年11月,中国国家药品监督管理局(NMPA)受理了索凡替尼用于治疗非胰腺神经内分泌瘤的新药上市申请(NDA),并于2019年授予了优先审查。此次NDA,基于在中国成功完成的SANET-ep研究(NCT02588170)的数据支持,这是一项III期研究,在没有有效治疗方法的非胰腺(胰腺外)晚期NET患者中开展。2019年6月进行了198例患者的中期分析,独立数据监测委员会(IDMC)确定研究达到了预先指定的无进展生存期(PFS)的主要终点,应尽早停止。这项试验的积极结果在2019年欧洲医学会(ESMO)上进行了口头报告。
中国胰腺神经内分泌(NET)开发项目:2016年,和黄医药启动了SANET-p研究(NCT02589821),这是在中国开展的一项治疗低级、中级、晚期胰腺NET患者的关键III期研究。2020年1月进行中期分析审查后,由于研究已经达到预先指定的PFS主要终点,IDMC建议尽早终止这项注册研究。该研究的结果将在即将召开的科学会议上公布。目前,索凡替尼的第二份NDA,即用于治疗晚期胰腺NET患者的NDA正在准备提交。
中国胆管癌开发项目:2019年3月,和黄医药启动了一项IIb/III期研究(NCT03873532),在接受一线化疗后病情进展的晚期胆管癌患者中,将索凡替尼与卡培他滨(capecitabine)进行了比较。主要终点是总生存期(OS)。
免疫治疗组合开发项目:2018年11月和2019年9月,和黄医药签订了合作协议,以评估索凡替尼与抗PD-1单抗联合用药的安全性、耐受性和疗效。这包括全球合作评估索凡替尼与君实生物抗PD-1单抗拓益 (特瑞普利单抗)的联合用药,以及与信达生物抗PD-1单抗达伯舒 (Tyvyt ,信迪利单抗)的联合用药。(100医药网100yiyao.com)
原文出处:
医药网新闻
- 相关报道
-
- Nature Methods:蛋白质“变形金刚”设计指南——AI“脑补”自然进化,一键生成智能分子开关 (2025-08-10)
- N Engl J Med:改写移植规则!从“免疫耐受”迈向“免疫规避”的新纪元 (2025-08-10)
- Science重磅:破解阿尔茨海默病抗体药的脑出血副作用——突破血脑屏障,靶向递送抗Aβ抗体 (2025-08-10)
- Nat Rev Neurosci重要综述:自主神经系统的分子和功能多样性——系统回顾了该领域近十年来的关键进展 (2025-08-09)
- Cancer Cell:于君团队证实,补充这种益生菌,可增强结直肠癌免疫治疗效果 (2025-08-09)
- Cancer Cell:魏嘉/李颜团队揭示未成熟中性粒细胞在癌症骨转移中的关键作用,并提出治疗新策略 (2025-08-09)
- 为何CAR-T 疗法易复发?Mol Cancer:细胞衰老成“隐形杀手”,共刺激域差异决定疗效命运 (2025-08-08)
- Nature:多发性硬化症的“元凶”现身?科学家揭示EB病毒惊人发现! (2025-08-08)
- Nature:锂缺乏或会诱发阿尔兹海默病,但锂化合物却能逆转小鼠疾病 (2025-08-08)
- 不止供能,还能抗癌?!Cell Metabol:葡萄糖能帮抗癌 T 细胞“充电”!糖鞘脂合成是关键 (2025-08-08)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















