《科学·进展》:中国科学家发现胆固醇实际上是帕金森病 |
 |
本研究中,欧阳波等首先在人细胞系(RKO)中进行了免疫荧光染色和共定位分析,发现PD-L1与胆固醇之间存在很强的空间相关性。
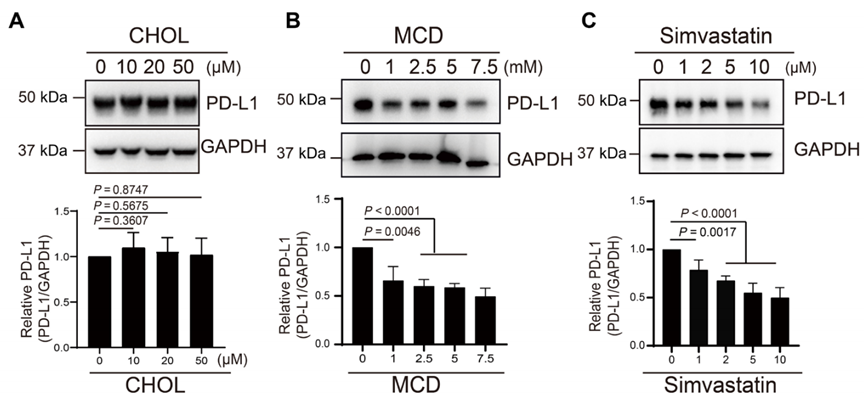
随后,研究人员分别用胆固醇、甲基环糊精(MCD)和辛伐他汀处理RKO细胞。其中,MCD和辛伐他汀具有降低胆固醇的作用。
蛋白质印迹分析和共聚焦成像的结果显示,向RKO细胞中加入胆固醇会增加质膜中胆固醇的含量,并且PD-L1的水平显著上调。然而,添加MCD或辛伐他汀的效果相反。胆固醇去除后,细胞表面PD-L1水平明显下降,内源性PD-L1的泛素化修饰增强,可能与其泛素化降解有关。
对于PD-L1来说,胆固醇似乎有些特别。
研究人员在人类永生化骨髓细胞系K562中进一步验证了上述结论。这一次,他们在K562细胞中加入干扰素(IFN-)来刺激其表达PD-L1,导致K562细胞中PD-L1水平的上调。发现当使用MCD或辛伐他汀降低胆固醇水平时,K562细胞中PD-L1的水平仍然显著下调。
这些体外实验表明,胆固醇在维持细胞中PD-L1水平方面起着至关重要的作用。
利用多功能核磁共振(NMR)等技术,研究人员进一步表征了PD-L1的跨膜域(PD-L1-TC),描述了其构象,并表明PD-L1在与两个胆固醇分子结合时表现出良好的稳定性。
具体来说,PD-L1依赖其跨膜结构域中的两个胆固醇结合基序CRAC1和CRAC2来识别胆固醇并与之相互作用。CRAC1基序中的F257和F259结合位点通过疏水相互作用与胆固醇相互作用。CRAC2基序中R260和R262的结合位点通过氢键与胆固醇相互作用。在这种情况下,PD-L1被胆固醇包裹成三明治结构,从而增加了其在细胞膜上的稳定性。
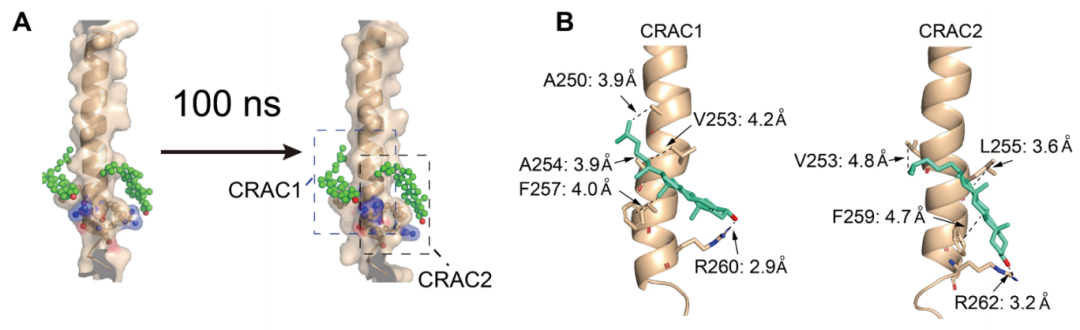
这两个图案看起来像这样。
最后,研究人员验证了PD-L1如果想接近胆固醇来拯救自己,就要依赖于CRAC1和CRAC2两个基序的正常表达。
他们特异性地敲除了这两个基序上的胆固醇结合位点,以产生分别表达PD-L1F257A、PD-L1F259A、PD-L1R260A和PD-L1R262A突变体的RKO细胞。结果显示,与表达野生型PD-L1的RKO细胞相比,这四种不同结合位点突变的RKO细胞的PD-L1 mRNA水平相似,但PD-L1蛋白突变体的泛素化水平更高(下图A),降解速度更快(下图C),细胞膜表面的PD-L1水平更低(下图B)。
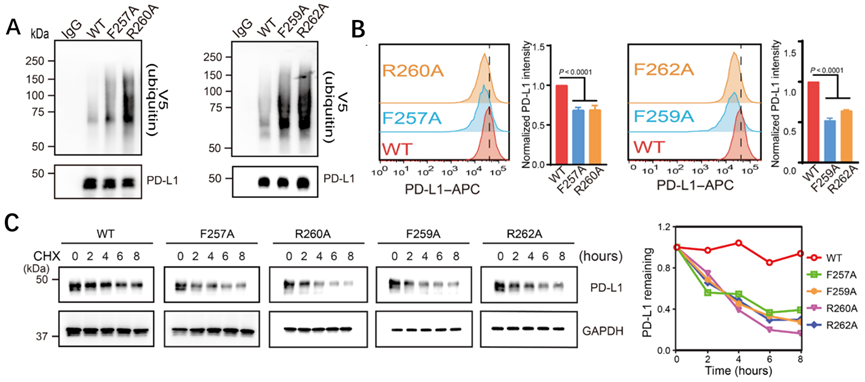
对于CRAC,胆固醇保护PD-L1免于被泛素化降解。
一般来说,PD-L1具有独特的构型以确保其稳定性。依靠两个关键的CRAC胆固醇基序,PD-L1与胆固醇结合,防止自身被降解。当这两个基序发生突变时,PD-L1与胆固醇的结合将被破坏,PD-L1的降解将加重。
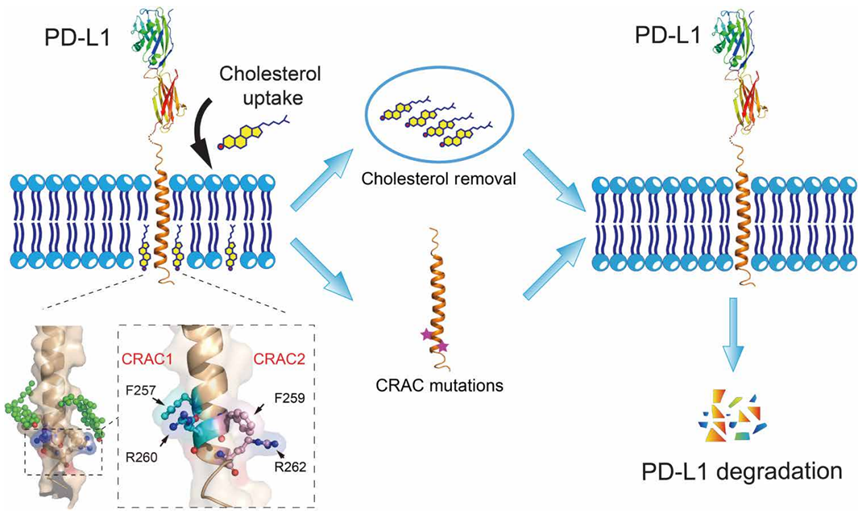
让我们有一个简单明了的机理图。
此外,这项研究再次证实,用降胆固醇药物治疗可以降低肿瘤细胞表面的PD-L1水平。然而,这与以往的研究结论仍有许多不同之处。
以往的研究表明,他汀类药物可以通过抑制蛋白激酶B(AKT)和-catenin介导的信号通路,降低肿瘤细胞中PD-L1的表达[3]。此外,辛伐他汀可以通过抑制长链非编码RNA(SNHG29)的表达来抑制PD-L1的表达[4]。显然,两项研究都显示了他汀类药物的间接作用,即调节PD-L1相关因子的活性,进而下调PD-L1的水平。
医药网新闻
- 相关报道
-
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 槲皮素哪个牌子好?槲皮素品牌前十名:肺结节该怎么选? (2025-10-25)
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















