姚哈医大一院团队发现 补充支链氨基酸可能会缓解帕金森病症状! |
 |
调节肠道菌群可以治疗神经退行性疾病吗?
人们常说,肠道是人类的第二个大脑。近年来,关于肠道菌群在神经退行性疾病中的作用一直存在不同意见。肠道菌群失调被认为是许多神经系统疾病的根源,肠道菌群代谢产物中的氨基酸被认为是影响脑稳态的重要物质[1]。那么,调节肠道菌群可以治疗神经退行性疾病吗?
近日,哈尔滨医科大学附属第一医院姚教授团队研究发现,与对照组小鼠相比,帕金森病模型小鼠肠道菌群有明显变化,高支链氨基酸饮食可明显缓解小鼠运动障碍和神经病理改变。该结果发表在《大脑行为和免疫》杂志上[2]。

研究人员使用了帕金森病的经典药物模型:口服鱼藤酮的小鼠模型。鱼藤酮为脂溶性药物,外周给药后可通过血脑屏障作用于中枢。该模型造模时间短,可特异性导致黑质多巴胺能神经元死亡,也可模拟-Syn聚集的病理表现[3]。研究人员选择口服给药,可以同时引起中枢神经系统和胃肠道的病变,从而观察肠道菌群在帕金森病中的作用。
在实验过程中,每天给小鼠喂一次剂量为30毫克/公斤的鱼藤酮,持续4周。分别在0周(对照组)、3周、4周观察小鼠肠道菌群、血清氨基酸含量的变化以及与帕金森病相关的行为和病理变化。
发现服用鱼藤酮4周后,小鼠出现明显的肠道功能障碍(便秘、粪便含水量减少)、运动障碍(转轴和爬杆实验结果差异显著)和病理改变(黑质多巴胺能神经元死亡)。服药3、4周后小鼠肠道组织中检测到磷酸化-Syn(病理蛋白),服药4周后小鼠脑内开始出现磷酸化-Syn。
同时,服用鱼藤酮后,小鼠肠道菌群也发生了明显变化。
服用鱼藤酮3周后,厚壁菌门的比例显著增加,拟杆菌门的比例显著下降。在第4周,厚壁菌门/拟杆菌的比例在第3周增加了230%,但在第4周下降了51.6%。在分析菌群多样性时,对服用鱼藤酮0周、3周和4周的小鼠肠道菌群进行了比较,发现服用鱼藤酮0周和4周的小鼠肠道菌群的种类和分布差异最明显,不同细菌的聚类分析也发现肠道菌群随服用鱼藤酮的时间动态变化。
提示肠道菌群的变化与药物的作用时间密切相关。
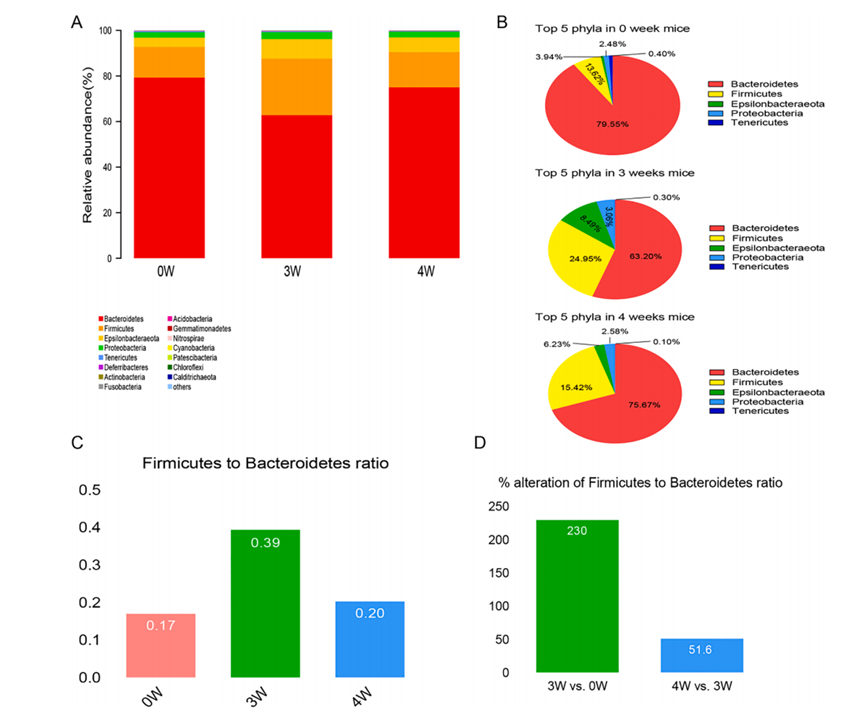
图为服用鱼藤酮后0、3、4周小鼠肠道菌群的变化。
接下来,机器学习算法建立的预测模型也印证了这一点。机器学习算法可以测量小鼠服药后0周和4周的肠道菌群,拟合度为92.41%,而可以区分3周和4周的肠道菌群变化,拟合度为86.06%。
肠道菌群的变化往往意味着代谢产物的变化,而代谢产物是最终影响神经系统的关键。接下来,研究人员检测了小鼠血清中的19种氨基酸,发现在接受四周治疗的小鼠中,亮氨酸、异亮氨酸和缬氨酸有所下降。分析代谢途径后发现,这三种氨基酸的降解代谢增加,合成代谢减少。
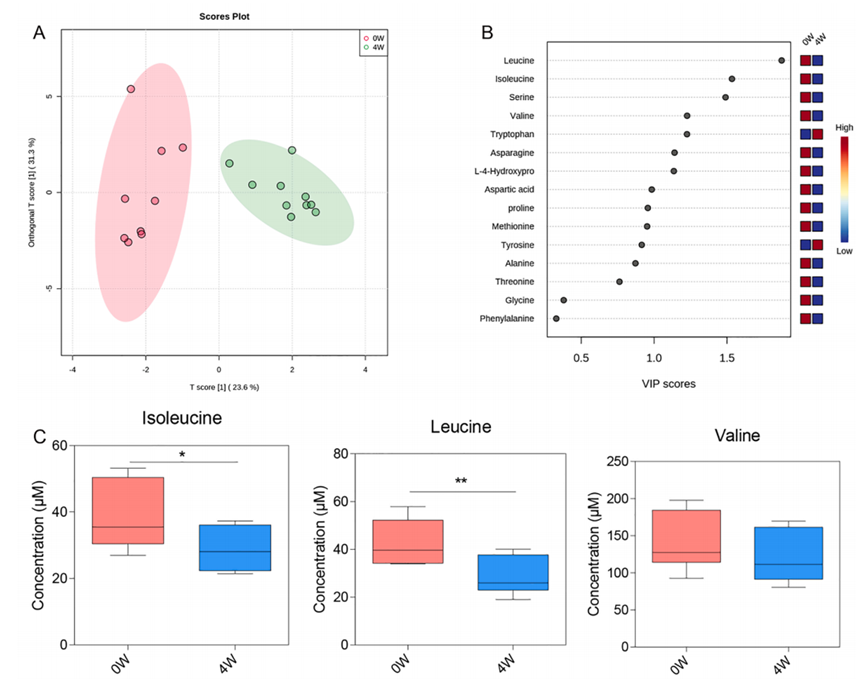
图为服用鱼藤酮4周的小鼠血清氨基酸代谢的变化。
亮氨酸、异亮氨酸和缬氨酸统称为支链氨基酸(BCAA),是人体必需氨基酸。那么,小鼠的严重病理表现是否与药物作用后这三种氨基酸的减少有关呢?
研究人员试图通过口服BCAA来治疗服用鱼藤酮的小鼠。在服用鱼藤酮的四周前,研究人员开始用高BCAA饮食喂养老鼠。结果表明,与普通饲料喂养的小鼠相比,高BCAA饲料喂养的小鼠便秘得到改善,在爬杆试验和旋转轴试验中运动障碍得到恢复,黑质多巴胺能神经元死亡也得到明显改善。
口服鱼藤酮后,小鼠结肠和黑质中三种炎症因子的前体蛋白TNF-、IL-1和IL-6的水平显著升高,而高BCAA饮食治疗后三种炎症因子的水平也显著降低。
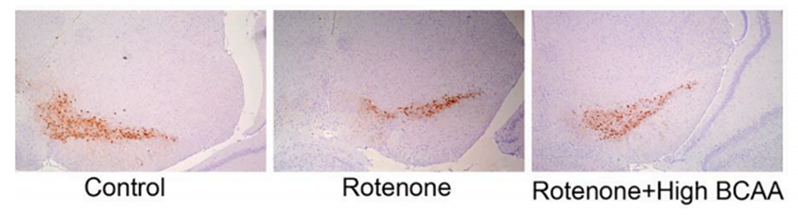
对照组(control)、鱼藤酮组(Rotenone)和鱼藤酮组(Rote)
none+ high BCAA)多巴胺能神经元死亡情况变化大家可能会奇怪,单纯补充了几种氨基酸怎么就能带来这么显著的变化呢?
首先,帕金森病主要累及黑质区多巴胺能神经元的一个原因就是黑质区的能量需求较高,当机体能量供应不足时,黑质区就会首先受累[4],而支链氨基酸的分解代谢可以作为三羧酸循环的补充为细胞提供能量,所以帕金森病模型小鼠中几种支链氨基酸含量的下降可能就是因为能量需求的增加[5]。补充支链氨基酸可能缓解了能量供应不足从而挽救了黑质区多巴胺能神经元的死亡。
另外,补充支链氨基酸后,小鼠的肠道和大脑中炎症反应都下降了,而炎症反应也是帕金森病重要的病因之一。支链氨基酸对于炎症反应的调节机制还有待进一步探究,可能与调节细胞增殖有关。
口服鱼藤酮的小鼠帕金森病模型虽然可以模拟出帕金森病过程中的很多病理特征,但依然不能与自然发生的帕金森病相比。这篇文章的结果不禁让人好奇,帕金森病患者中是否也存在类似的肠道菌群和氨基酸代谢的改变。如果BCAA的疾病保护作用可以在人类身上实现,那无疑可以为帕金森病的预防和治疗带来突破。
参考文献
[1] Ahn IS, Yoon J, Diamante G, Cohn P, Jang C, Yang X. Disparate Metabolomic Responses to Fructose Consumption between Different Mouse Strains and the Role of Gut Microbiota. Metabolites. 2021;11(6):342. Published 2021 May 26. doi:10.3390/metabo11060342
[2] Yan Z, Yang F, Sun L, et al. Role of gut microbiota-derived branched-chain amino acids in the pathogenesis of Parkinson s disease: An animal study. Brain Behav Immun. 2022;106:307-321. doi:10.1016/j.bbi.2022.09.009
[3] Chia SJ, Tan EK, Chao YX. Historical Perspective: Models of Parkinson s Disease. Int J Mol Sci. 2020;21(7):2464. Published 2020 Apr 2. doi:10.3390/ijms21072464
[4] Subramaniam SR, Chesselet MF. Mitochondrial dysfunction and oxidative stress in Parkinson s disease. Prog Neurobiol. 2013;106-107:17-32. doi:10.1016/j.pneurobio.2013.04.004
[5] Liu S, Li L, Lou P, et al. Elevated branched-chain -keto acids exacerbate macrophage oxidative stress and chronic inflammatory damage in type 2 diabetes mellitus. Free Radic Biol Med. 2021;175:141-154. doi:10.1016/j.freeradbiomed.2021.08.240
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Cell:单舒瓯院士团队揭开线粒体上的“VIP通道”,让大型复杂蛋白在翻译的同时插队进入线粒体 (2025-08-13)
- 医保局反内卷!药械集采将迎竞争新格局? (2025-08-13)
- 迈威生物靶向 Nectin-4 ADC 创新药 9MW2821 完成美国 ADC 经治三阴性乳腺癌临床试验首例患者给药 (2025-08-12)
- 庄小威最新Science论文:揭示神经元膜骨架由钙信号驱动的持续性动态重塑 (2025-08-12)
- 《自然·代谢》:这样吃,二甲双胍疗效更好!二甲双胍联合FODMAP,可改善餐后血糖、GLP-1分泌,增加丁酸盐产生菌,降低炎症 (2025-08-12)
- Cell子刊:华人学者开发新型纳米药物,穿越血脑屏障,治疗阿尔茨海默病 (2025-08-11)
- Nature:科学家成功开发出一种突破性的抗结核药物——CMX410 (2025-08-11)
- Nature:生命的“化学伪装”——RNA N-糖基化,一种被忽视的免疫调控艺术 (2025-08-11)
- Nature:从绝望到希望——脑部细胞移植或为遗传性脑病患者打开生命之门 (2025-08-11)
- 《自然》子刊:缺氧竟能保护神经元!哈佛团队发现,低氧空气会在大脑中构筑“抗毒性”环境,预防/挽救帕金森病相关神经元丢失和运动障碍 (2025-08-10)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















