李博文等开发新型LNP载体,吸入后可实现对肺部的高效mRNA递送及基因编辑 |
 |
来源:生物世界 2023-04-06 17:08
利用高通量平台,研究团队合成和筛选了可生物降解的可电离脂质组合文库,以构建用于递送mRNA和CRISPR-Cas9基因编辑器的吸入式递送载体。先天性肺部疾病,例如表面活性蛋白缺乏症、囊性纤维化、 -1抗胰蛋白酶缺乏症等等,会导致终身发病甚至是死亡。虽然这些疾病的遗传机制已经被深入研究,但仍然缺乏有效的治疗方案。最近,可吸入式mRNA递送平台备受制药业和学术界的关注。这种平台可以提供非侵入性、直接进入肺上皮细胞和肺泡的RNA药物,在应用于囊性纤维化、特发性肺纤维化、和肺部感染等多种肺部疾病治疗方面有巨大潜力。
以CRISPR-Cas9为代表的基因编辑工具,通过气管内递送到肺部细胞,是一种极具潜力的治疗先天性肺部疾病的方法。目前,已经使用腺相关病毒(AAV)在人体内进行了基因编辑治疗。
然而,AAV载体递送Cas9的DNA在体内的长期表达,虽然提高了成功编辑的效率,但也会导致脱靶编辑的积累。此外,AAV衣壳的原性限制了其重复给药,更重要的是,AAV载体容量有限(不超过4.7kb),这导致其难以递送编辑效率更高的spCas9。
而AAV病毒载体面临的这些挑战和限制,可以通过非病毒载体来递送mRNA来解决,从而实现短暂表达和重复给药,而且能够突破载体容量限制。
脂质纳米颗粒(LNP)是目前临床试最先进的非病毒载体,随着在新冠mRNA上的成功应用而被广泛接受,在临床试验中,LNP递送的Cas9 mRNA实现了肝脏遗传疾病的有效治疗。
然而,目前还没能通过吸入的方式利用LNP递送系统在体内进行高效的肺部基因编辑。与肝脏相比,肺部特殊的细胞类型、粘液屏障和粘液纤毛清除系统对吸入递送提出了独特的挑战。此外,相比于mRNA疫苗,基于mRNA的基因编辑对LNP的递送效率要求更高。
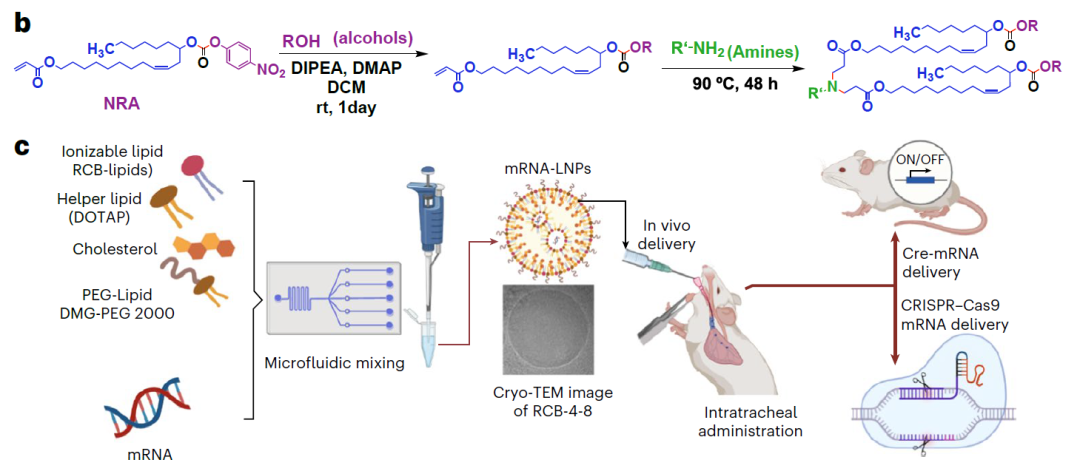
2023年3月,加拿大核酸疫苗与治疗研究主任(Canada Research Chair),多伦多大学药学院助理教授李博文联合麻省理工学院教授Robert Langer、Daniel Anderson和麻省大学医学院教授高光坪,薛文等人在Nature Biotechnology期刊发表了题为:Combinatorial design of nanoparticles for pulmonary mRNA delivery and genome editing(用于肺部mRNA递送和基因组编辑的纳米颗粒的组合设计)的研究论文,并与负责该论文审阅的编辑团队和专家以Research Briefing形式对其主要研究结果共同进行了总结和展望:First lipid nanoparticle-enabled gene editing in the lung via inhalation。
利用高通量平台,研究团队合成和筛选了可生物降解的可电离脂质组合文库,以构建用于递送mRNA和CRISPR-Cas9基因编辑器的吸入式递送载体。并从中筛选和鉴定了RCB-4-8LNP,这种领先的脂质纳米颗粒(LNP)具有更好的生物可降解性和安全性,可重复气管内给药。它提供了全球首个成功利用LNP实现高效肺上皮细胞基因编辑的方法,为先天性肺部疾病的基因治疗开辟了新的途径。


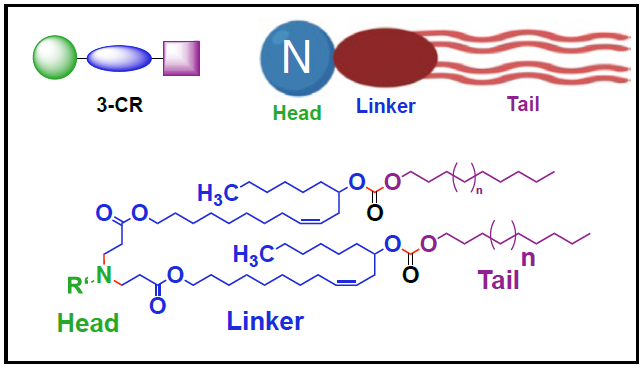
在这项研究中,研究团队设计了一个三组分反应(3-CR)体系,其中硝基蓖麻油酸丙烯酸酯(NRA)连接剂与脂肪醇(脂质尾)偶联,然后与含有伯胺、仲胺或叔胺的头部基团连接。与传统的将胺类头部基团直接与脂质尾结合的双组分反应相比,该三组分反应(3-CR)体系简化了繁琐的合成过程,增加了脂质结构多样性,快速生成了结构多样化的生物可降解电离脂质组合库。
研究团队合成了一个包含新的720种不同脂质的文库,由10个不同长度脂质尾和72个不同头部基团通过NRA连接子连接构成。该脂质文库中所有的可电离脂质都含有大量的酯类和碳酸盐基团,以提高可电离脂类的生物降解性,这有助于减少潜在不良反应,增强了与多剂量方案的兼容性。
通过体内动物实验和体外细胞实验的筛选,研究团队发现,RCB-4-8LNP在体内显示出对肺部最高的转染效率(递送Luciferase荧光素酶的mRNA),并在体外显示出最高的基因敲除效率(递送CRISPR-Cas9系统mRNA组分)。
之前的研究显示,使用阳离子脂质DOTAP替代DOPE,可有效提高全身给药后LNP在肺部的转染效果。在这项最新研究中,研究团队使用DOTAP重新配置了RCB-4-8 LNP,结果显示,其气管内给药递送Luciferase荧光素酶的mRNA后在肺部表达效率得到了进一步改善,这可能是新的阳离子脂质组成可以增强LNP的肺细胞内化和粘液驻留。
此外,与直接使用移液管混合的LNP配置方式相比,通过微流控技术产生的LNP具有更小的尺寸,更低的聚合物分散性指数(PDI)和更高的封装效率。
进一步的剂量反应实验显示,相比已批准的MC3-LNP(为Alnylam公司2018年获批RNA药物ONPATTRO 中所使用的LNP),RCB-4-8 LNP对肺部的转染效率提高了约100倍,相比近期开发的一款靶向肺部的新型LNP【2】,RCB-4-8 LNP对肺部的转染效率提高了10倍以上。
此外,在给药48小时后,RCB-4-8 LNP在肺中保留量 30%,而MC3-LNP则 90%,这表明表明RCB-4-8 LNP的潜在毒性较低。
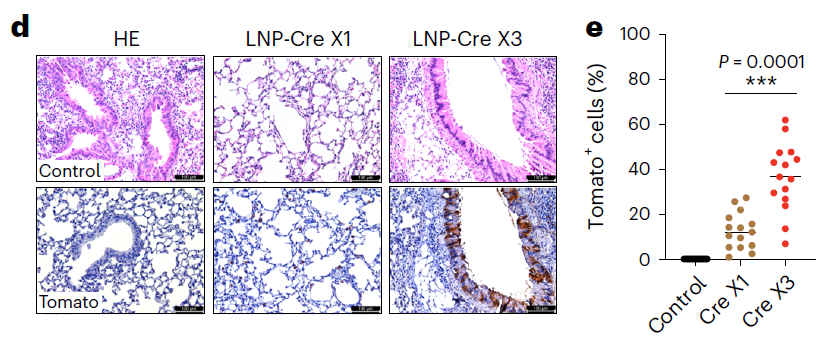
接下来,研究团队在Ai9 tdTomato小鼠模型中检验了RCB-4-8 LNP递送Cre重组酶mRNA(Cre-mRNA)介导的体内基因编辑的效果,结果显示,RCB-4-8 LNP递送的Cre-mRNA在气道中实现了良好的基因编辑效果,而且,三次给药进一步增加了基因编辑效果,这表明RCB-4-8 LNP可以重复给药,这与现在常用的AAV病毒载体相比是一个非常显著的优势。
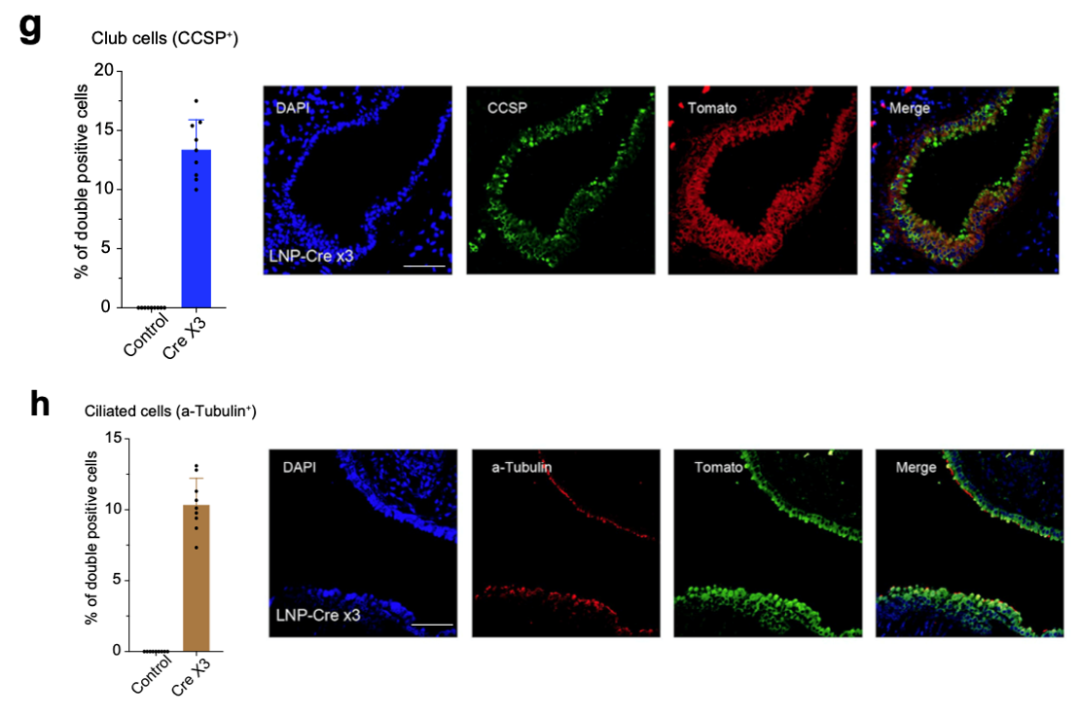
同时研究表明,RCB-4-8对纤毛上皮细胞(a-Tubulin+)和Club上皮细胞(CCSP+),这两种先天性肺部疾病的主要发病细胞,都可以实现高效的基因编辑。
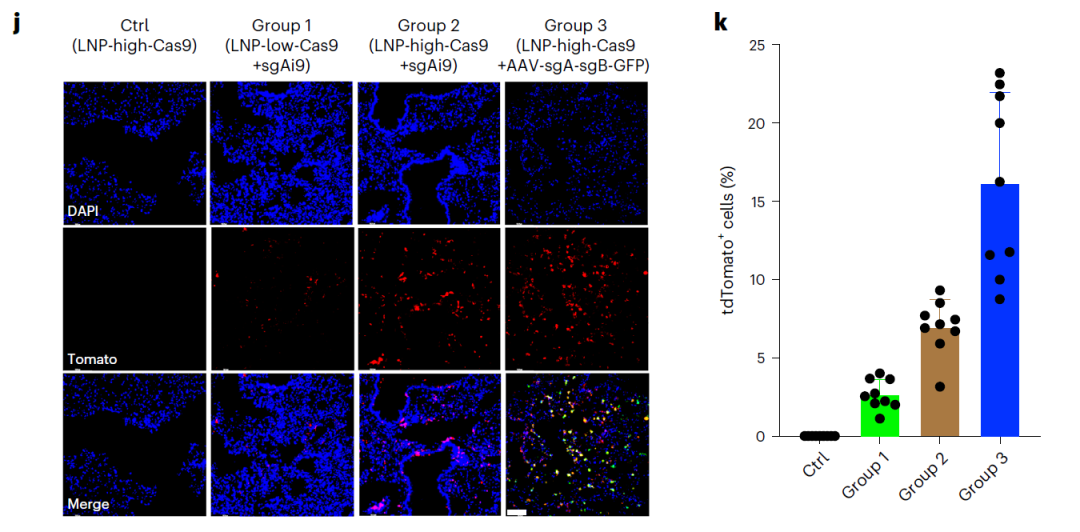
接下来,研究团队在Ai9 tdTomato小鼠模型中探索了使用RCB-4-8 LNP向肺部递送CRISPR-Cas9组分的可行性。不同剂量的LNP与AAV5递送相比,高剂量RCB-4-8 LNP递送Cas9 mRNA后编辑效率与最近报道的双AAV载体介导的Cas9的编辑效率相当。而LNP递送mRNA的瞬时性能够避免AAV递送Cas9的长期表达带来的脱靶性等潜在风险。
总的来说,这些令人信服的实验结果证明了RCB-4-8 LNP在肺中实现CRISPR-Cas9基因编辑方面的巨大潜力。
综上所述,该研究合成并评估了一个可生物降解的可电离脂质文库,其中RCB-4-8 LNP被鉴定为能够实现高效的肺部mRNA递送和基因编辑。与基于AAV病毒的DNA递送系统相比,LNP递送mRNA的半衰期相对较短,从而减少了Cas9长期表达积累脱靶效应的潜在风险。此外,与AAV病毒载体不同的是,LNP可以重复给药,这对于在肺部达到治疗性基因编辑水平可能是至关重要的。
与mRNA疫苗相比,基于mRNA的治疗药物和基因编辑的发展路径面临额外的挑战。免疫接种只需要产生最少量的蛋白质,因为免疫系统可以通过细胞介导和抗体介导的免疫反应显著放大抗原信号。相比之下,mRNA治疗需要高达1000倍的蛋白质水平才能达到治疗阈值【3】。此外,mRNA治疗还需要作用于特定的靶通路、细胞、组织或器官,这对其递送系统提出了更高的要求。
该研究已经证明了RCB-4-8 LNP的高效性,该纳米颗粒可以将CRISPR-Cas9系统以mRNA形式高效递送到肺中的纤毛上皮细胞和Club上皮细胞,证明了将mRNA用于治疗各种肺部疾病,包括囊性肺纤维化(CF)的基因编辑治疗的可行性和巨大潜力。
Nature Biotechnology同期还配发了来自以色列特拉维夫大学的Dan Peer教授的题为:CRISPR editing in the lung with novel lipids的 新闻与观点 文章。
Dan Peer教授指出,李博文等人使用改进的脂质纳米颗粒(LNP)通过吸入式递送可以在小鼠肺部细胞进行CRISPR基因编辑,这种方法有助于开发有效治疗肺部疾病的基因编辑药物,通过进一步优化,推动mRNA技术的临床应用。他还表示,与传统疫苗和疗法相比,该mRNA-LNP平台具有几项明显优势,包括无细胞体系、可快速生产、高通用性,以及良好的安全性。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- ESMO创纪录!中国药企策略跃迁:从大单品到“爆品链” (2025-10-19)
- 登上Cell封面:中国科学院将CRISPR基因编辑与AI机器人结合,推动可持续农业发展 (2025-10-19)
- Nature子刊:启动子编辑,实现对转基因表达的精准调控 (2025-10-19)
- Nature Biotechnology:合成生物学新里程碑——DIAL框架下的启动子编辑新策略,实现基因表达的“无级变速” (2025-10-19)
- Science:我们与线粒体的古老契约——细胞如何清理“坏基因”? (2025-10-19)
- Nature:解剖代谢“双城”——AI深度学习揭示肝肠内部的功能新图景 (2025-10-18)
- JEM:黄波/张晓辉团队破解JAK2V617F突变引发血小板抑或红细胞增多的分子机制 (2025-10-18)
- 利奥制药在中国递交上市许可申请,持续推进Anzupgo®(德戈替尼乳膏)的全球可及 (2025-10-17)
- Nature:破解遗传密码!汉族人群多基因风险评分的突破性研究 (2025-10-17)
- Nature 揭秘大脑“我意已决”的瞬间:AI 抓包大脑“关门拒听”瞬间,神经轨迹突然大转弯 (2025-10-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















