徐瑞华/鞠怀强团队揭示IL |
 |
来源:生物世界 2023-06-01 10:28
该研究解析了IL-1β通过诱导NNT乙酰化抑制肿瘤细胞铁死亡并介导免疫治疗抵抗的新机制,明确了炎症微环境可通过重塑肿瘤代谢降低免疫治疗疗效,拓宽了对炎症微环境在肿瘤代谢重编程及抗肿瘤免疫中作用的认知,恶性肿瘤的发生发展伴随着机体系统功能紊乱和免疫监视功能失调。治疗通过主动或被动的方式重新激活免疫系统,恢复其免疫监视功能以达到控制及清除肿瘤的目的,是肿瘤治疗领域的革命性突破。
近年来,中山大学肿瘤防治中心徐瑞华教授团队在临床实验中证实了相比于单纯化疗,食管癌患者更能从 PD-1抗体+化疗 模式中获益,进一步的转化研究证实也只是部分病人能够真正获益,仍有相当比例的 冷肿瘤 (如肠癌、肾癌等)患者对此类免疫疗法响应较差,长期获益比例低。肿瘤微环境的免疫抑制状态是导致免疫检查点阻断剂治疗失败的重要原因之一,深入探索肿瘤微环境抑制抗肿瘤免疫的作用方式和调控机制将为肿瘤免疫治疗提供潜在的新靶点和新策略。
炎症微环境是肿瘤的特征之一,至少有25%的肿瘤在发生学上与慢性炎症相关。此外,长期服用非甾体类抗炎药也在多种肿瘤中被证明可以降低癌症发病率。白介素1 (IL-1 )是一种重要的促炎细胞因子,其基因多态性与、、和等多种肿瘤的发生发展密切相关。既往研究表明,IL-1 可通过激活NF- B通路招募MDSC至肿瘤微环境从而抑制抗肿瘤免疫,但以此为基础进行的在PD-1抗体与含铂化疗基础上额外联合IL-1 中和抗体治疗非小细胞肺癌的III期临床试验却宣告失败,提示IL-1 影响抗肿瘤免疫的作用机制需要更为深入的研究。以往针对IL-1 的研究绝大部分聚焦于其对肿瘤微环境中免疫细胞或炎症细胞的调控,而IL-1 对肿瘤细胞的直接作用及其在抗肿瘤免疫中的意义仍不明确。
肿瘤代谢重编程与肿瘤恶性增殖、转移及免疫治疗抵抗密切相关。中山大学徐瑞华团队一直致力于研究胃肠道肿瘤的临床诊治策略与基础转化研究,近期发现:靶向叶酸代谢关键酶MTHFD2破坏氧化还原稳态抑制恶性进展;肿瘤甲硫氨酸代谢以m6A依赖的方式增强免疫检查点转录水平从而促进免疫逃逸,展现了代谢调控在肿瘤发生发展中的重要作用。因此,明确炎症微环境是否通过调控肿瘤代谢介导免疫治疗抵抗并阐明其分子机制对于提高免疫治疗疗效具有重要意义。
2023年5月25日,中山大学肿瘤防治中心徐瑞华/鞠怀强教授团队在Cell子刊Molecular Cell上发表了题为:IL-1 -associated NNT acetylation orchestrates iron sulfur cluster maintenance and cancer immunotherapy resistance的研究论文。
该研究揭示了IL-1 可通过诱导肿瘤细胞线粒体内膜蛋白NNT的乙酰化,从而调控铁硫簇稳态,进而抑制肿瘤细胞铁死亡并介导免疫治疗抵抗。

NNT定位于线粒体内膜,在质子动力势的驱动下催化NADP+生成NADPH,其对线粒体NADPH的贡献占比近50%。该研究发现,IL-1 处理可显著诱导胃癌细胞中NNT乙酰化修饰的上调,进一步通过氨基酸位点突变及蛋白质谱鉴定出K1042位点是受IL-1 调控的关键乙酰化修饰位点。
机制研究表明,IL-1 通过诱导乙酰基转移酶PCAF进入至线粒体介导NNT K1042乙酰化,该位点的乙酰化可增强NNT与其底物NADP+的亲和力从而增强催化活性,进而促进NADPH的合成。在线粒体中NADPH参与维持铁硫簇稳态及含铁硫簇蛋白的功能。该研究发现,IL-1 处理可显著提高NNT野生型肿瘤细胞内含铁硫簇蛋白的功能,而NNT K1042位点突变的肿瘤细胞对IL-1 无响应。
铁硫簇是细胞内铁离子的感受器,铁硫簇不足会导致细胞启动铁饥饿反应(iron-starvation response)从而上调铁转运体TFRC的表达水平进而从胞外摄取大量铁,导致细胞铁过载(iron overload)。
铁死亡(ferroptosis)是一种铁离子依赖的由脂质过氧化物过度累积导致的调控性细胞死亡,细胞内的铁过载会增加其对铁死亡的敏感性。该研究发现在铁死亡压力下,IL-1 可显著降低NNT野生型肿瘤细胞内的亚铁离子和脂质过氧化水平从而保护细胞免于发生铁死亡但对NNT K1042位点突变的肿瘤细胞无保护作用。
既往研究表明,CD8+T细胞可通过分泌IFN- 抑制肿瘤细胞xCT的表达并重塑脂代谢以诱导肿瘤细胞铁死亡。
为探究IL-1 能否通过诱导NNT乙酰化协助肿瘤细胞抵抗免疫治疗引发的铁死亡,研究者构建了多种小鼠肿瘤模型,结果表明,联用IL-1 中和抗体或阻断NNT乙酰化可显著增加PD-1抗体治疗引发的肿瘤细胞铁死亡。此外,该研究引入了多种癌种的免疫治疗队列样本,结果表明,血清中IL-1 含量较高的肿瘤患者对免疫治疗的响应更差。
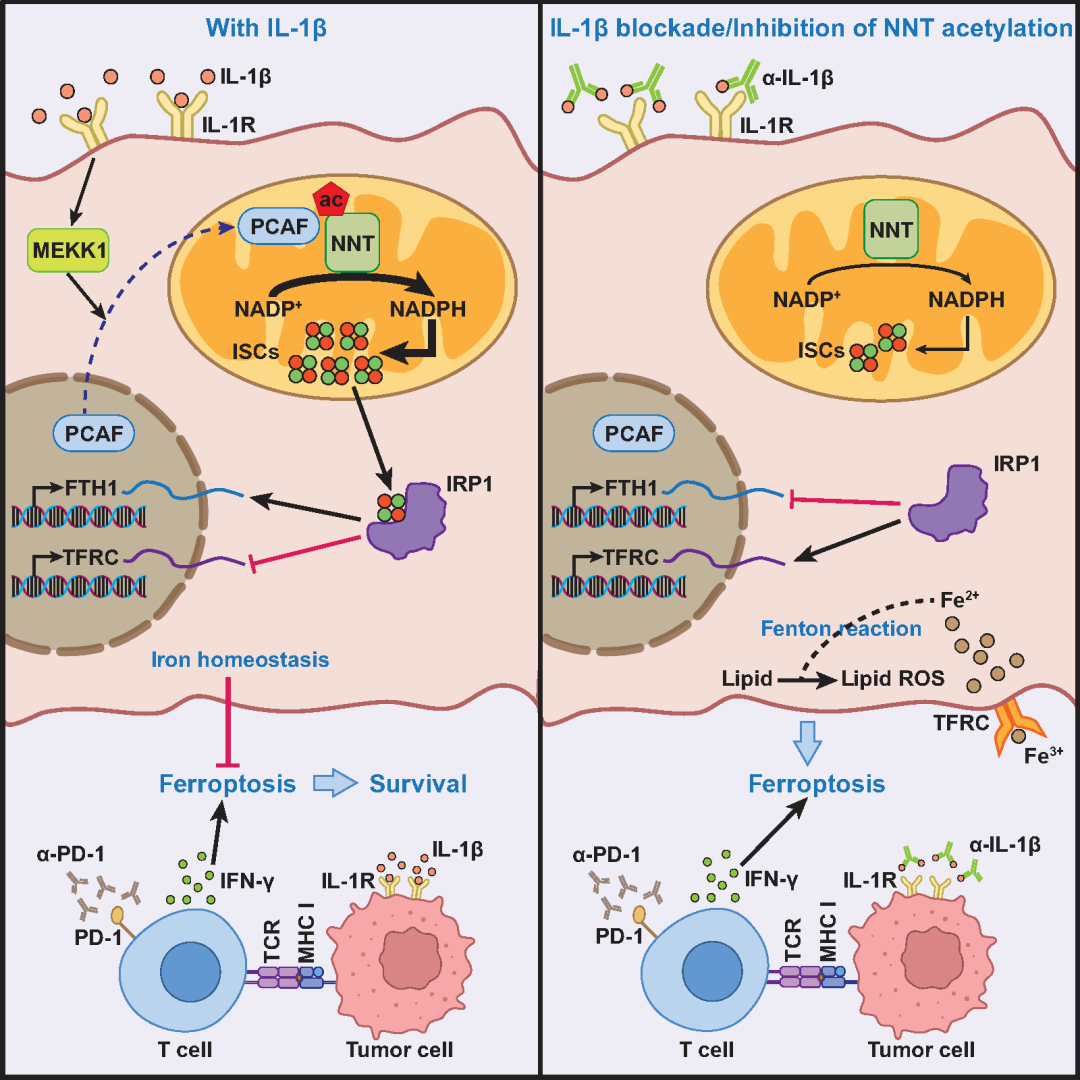
总的来说,该研究解析了IL-1 通过诱导NNT乙酰化抑制肿瘤细胞铁死亡并介导免疫治疗抵抗的新机制,明确了炎症微环境可通过重塑肿瘤代谢降低免疫治疗疗效,拓宽了对炎症微环境在肿瘤代谢重编程及抗肿瘤免疫中作用的认知,为开发新型免疫治疗策略提供了新的视角。
中山大学肿瘤防治中心徐瑞华教授和鞠怀强教授为论文通讯作者。中山大学肿瘤防治中心博士后韩轶、张燕宇和博士生潘艺芊为论文共同第一作者。研究工作也得到了黄蓬教授、袁庶强副主任医师、杨魏教授、刘泽先研究员、曾昭蕾副研究员、郑晓君副研究员和吴其年副主任医师等合作者的大力支持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 医工“破界”立异:为安康守护按下“快进键” (2025-10-17)
- 国度医保局:全面推动医保基金即时结算改造扩面提质 (2025-10-17)
- 医疗东西监管律例轨制研讨任务漫谈会在新疆召开 (2025-10-17)
- NEJM:指南终于要改写了!中山大学团队发现,前哨淋巴结活检阴性的早期宫颈癌患者无需盆腔淋巴结清扫 (2025-10-17)
- 国产CAR细胞疗法,又双叒叕登上顶刊 Cell:BCMA-CAR-T治疗进行性多发性硬化症 (2025-10-17)
- PNAS:精子也“飙车”?科学家发现能量开关,有望颠覆不孕与避孕未来 (2025-10-16)
- Cell:小胶质细胞-星形胶质细胞交谈调节突触重塑 (2025-10-16)
- 香港西医病院开院首年将提供门诊及日间住院等服务 (2025-10-16)
- 国度药监局对于刊出氯雷他定片等80个药品注册证书的布告 (2025-10-16)
- 《自然·神经科学》:从身到心,一次改善!单剂量裸盖菇素可快速且持续地缓解慢性疼痛小鼠痛觉异常和情绪障碍 (2025-10-16)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















