科研人员构建出全新的纳米载体靶向效率的高精度可视化评估方法 |
 |
中国科学院上海药物研究所张继稳团队联合临港实验室殷宪振团队,在《科学进展》(Science Advances)上,发表了题为Cross-scale tracing of nanoparticles and tumors at the single-cell level using the whole-lung atlas的研究论文。该研究基于显微光学断层扫描/荧光显微光学断层扫描系统(MOST/fMOST),在三维空间、单细胞水平上,构建了B16F10小鼠肺转移瘤病理图谱,阐明了纳米载体在肿瘤和临近组织的时空分布规律,定量评价了其在肿瘤组织内的渗透行为及靶向效率。该研究构建了全新的纳米载体靶向效率的高精度可视化评估方法,突破了现有肿瘤成像方法及瘤内纳米载体可视化技术的局限性,为纳米递药系统的设计和开发提供了新策略。
MOST系统在全器官尺度具有较高的分辨率,边切片、边成像,无需特异性标记,通过灰度和形态学差异即可实现多种病理结构的同步可视化。为了分析肺部肿瘤微环境的结构变化,评价生理结构的受损程度,研究基于MOST系统完成全肺肿瘤病理结构的跨尺度同步可视化,在三维空间、单细胞水平上全面地表征肺转移瘤的病理特征,包括对肺气管高精度内窥、解析病灶对周围肺泡挤压和侵袭的规律、全肺图谱内的肿瘤病灶分类以及各阶段肿瘤结构参数的定量分析等。结果表明,肿瘤血管系统在发展过程中经历着显著的三维结构变化,间接影响粒子在瘤内的空间分布。因此,研究肿瘤微环境和异质性的综合影响对认知肿瘤颇为重要,而结构参数的定量有助于更准确地理解复杂的肿瘤微环境(图1)。
进一步,研究以环糊精金属有机骨架为基本单元,设计、制备并表征了可主动靶向肿瘤组织的荧光纳米载体Nano-COF-A488-cRGD。该载体可被多种肺泡组织典型细胞摄取。fMOST系统适用于荧光样本,结合实时碘化丙啶(PI)复染,进行双通道荧光成像。为此,该研究定量考察了Nano-COF-A488-cRGD在肿瘤病灶中的渗透、聚集行为,发现了粒子在全肺瘤内分布与肿瘤内部纤维化程度有关。纳米制剂的肿瘤内渗行为需要依靠肿瘤自身的血管网络,血管结构的形态变化同样会影响粒子的瘤内分布。
纳米制剂的分布和肿瘤结构密切相关,对肿瘤的早期治疗具有重要意义,确认肿瘤血管网的结构有助于优化给药策略。该研究揭示了肺转移瘤的三维结构变化,弥补了跨尺度肿瘤成像分析方法学上的缺失,构建了全新的荧光纳米载体可视化方法,为揭示靶向递送系统的药物分布和药效学评价奠定了坚实基础。MOST系统可采集到淋巴和神经的结构信息、特异性抗体染色结合转基因动物以及荧光标记的肿瘤细胞建模,可通过fMOST系统研究淋巴系统,揭示肿瘤微环境与系统及神经系统的相互作用。同时,此方法还可应用到其他的药物递送载体、疾病模型和给药方式,对跨尺度三维空间、单细胞水平构建肿瘤病理图谱,具有重要意义和广泛需求。
上海药物所MOST及图像融合分析平台参与MOST/fMOST数据收集。本研究中的细胞摄取和定量评价得到国家蛋白质科学中心(上海高等研究院)的支持。研究工作得到战略性国际科技创新合作重点专项、临港实验室开放课题和江西省创新领军人才短期计划的资助。
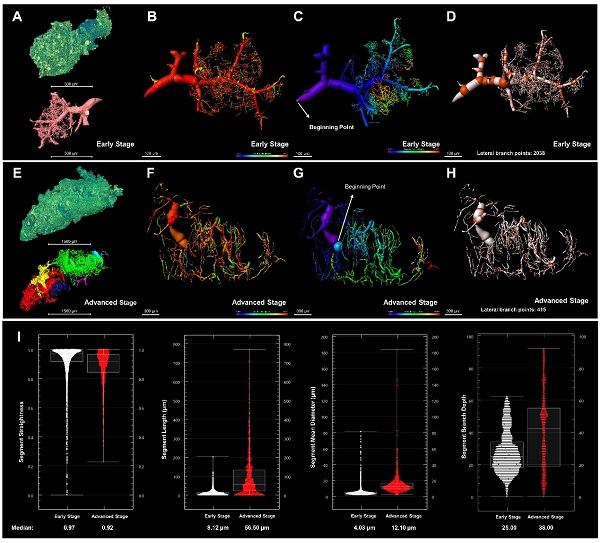
图1. C57BL/6小鼠全肺图谱血管系统的高精度三维可视化和定量。(A)早期肺转移瘤及其血管系统;早期转移灶血管片段的平直度(B)和分支深度(C);(D)早期血管片段的分支点;(E)晚期肺转移瘤及其血管系统;晚期转移灶血管片段的平直度(F)和分支深度(G);(H)晚期血管片段的分支点;(I)肺转移灶(早期-白色,晚期-红色)血管片段结构参数定量分析:平直度、长度、平均直径、分支深度。
医药网新闻
- 相关报道
-
- 明眸皓齿打一个正确的生肖,最佳资询落实 (2025-09-13)
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















