Science:从结构上揭示MKK6 |
 |
来源:100医药网原创 2023-09-26 13:37
细胞持续暴露于病原体等应激源,可能会扰乱生物的正常功能。为了对抗应激,细胞产生了多种应对机制,包括炎症反应。虽然炎症反应是必要的,但过多的炎症反应会损害细胞和器官的功能。细胞因子风暴就是这种情况---细胞持续暴露于病原体等应激源,可能会扰乱生物的正常功能。为了对抗应激,细胞产生了多种应对机制,包括炎症反应。虽然炎症反应是必要的,但过多的炎症反应会损害细胞和器官的功能。细胞因子风暴就是这种情况---感染期间的炎症级联反应可能会失控,导致严重的疾病甚至死亡。

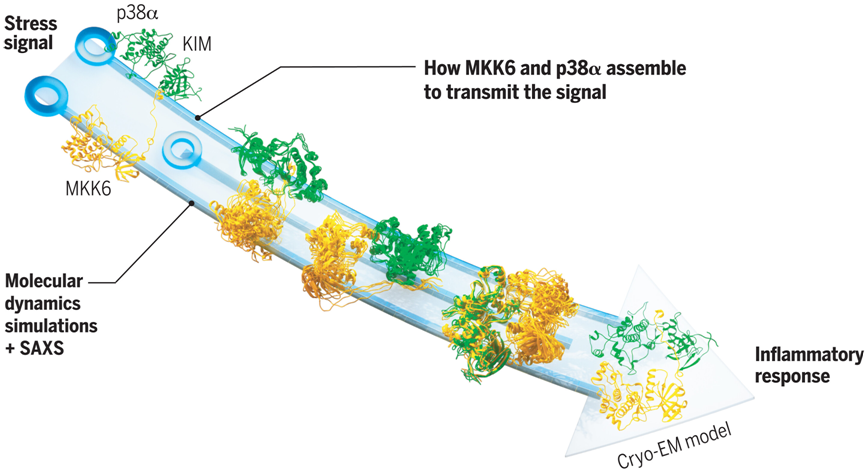
在一项新的研究中,来自欧洲分子生物学实验室和和日内瓦大学的研究人员提供了关于一种名为p38 的蛋白的重要新见解,其中这种蛋白属于丝裂原活化蛋白激酶(Mitogen Activated Protein Kinase, MAPK)家族,是触发炎症反应的重要细胞 开关 。他们首次获得了p38 被另一种调节蛋白激酶---MKK6---激活后的结构,为开发阻止细胞因子风暴的药物开辟了新方向。相关研究结果发表在2023年9月15日的Science期刊上,论文标题为 Architecture of the MKK6-p38 complex defines the basis of MAPK specificity and activation 。
最后的开关:药物靶标
论文共同通讯作者、欧洲分子生物学实验室研究员Matthew Bowler十多年来一直在研究激酶。这组酶通过充当传递信号和激活基因表达的 开关 ,在调节细胞内的复杂过程中发挥着重要作用。它们是通过磷酸化来实现的---在其他分子上添加一个磷酸基团来调节它们的功能。
Bowler的研究尤其侧重于参与炎症反应的关键角色---MAP激酶。炎症是通过一系列激酶启动的,这些激酶在一连串反应中相互激活,最后一个激酶负责激活炎症所需的基因转录。这一过程会释放细胞因子和促炎症信号分子,如果过度激活,就会导致细胞因子风暴。
这种激酶连锁反应受到良好调节,类似于逻辑电路:炎症反应需要特定的按钮才能开启,最终激活 p38 ---所有信号的汇聚点和炎症过程的最后一个开关。
由于这种激酶连锁反应可能来自逻辑电路的不同 分支 ,这最后一个开关是一个特别有临床意义的药物靶标。炎症反应受 p38 调节,在细胞因子风暴期间被高度激活。让它失活可以防止炎症发生,而不是在炎症已经发生时再试图治疗。
因此,人们对包括 p38 在内的蛋白激酶进行了大量研究。30 年前,第一个蛋白激酶结构被破解---这在该领域具有里程碑意义---随后又有更多结构被破解,目前蛋白数据库中已有 7000 多个蛋白激酶的结构。
MAP激酶激活的结构和动力学。图片来自Science, 2023, doi:10.1126/science.add7859。
然而,谜题的重要部分仍然缺失。Bowler解释说, 结构生物学家已经获得了有关蛋白激酶结构和功能的详细信息,但大多是孤立的。因此,我们并不真正了解这些酶是如何通过这种连锁反应被激活的。
由于不了解这种激活过程的基本信息,药物大多靶向蛋白激酶的核苷酸结合位点---这是所有激酶中常见的、众所周知的口袋,磷酸转移就发生在这里。由于不同蛋白激酶的结合位点相同,药物缺乏特异性,这意味着设计用于阻止一种蛋白激酶发出信号的药物也可能阻止其他蛋白激酶。考虑到蛋白激酶在细胞过程中的关键调节作用,这种副作用很成问题。
Bowler补充说, 有很多分子都是针对p38 设计的,尤其是它的核苷酸结合位点,但由于缺乏特异性,还没有一种分子能通过临床试验。
破解这种激活机制
因此,Bowler和他实验室的前博士生Erika Pellegrini从2009年起就开始研究p38 和MKK6(激活p38 的激酶)之间的相互作用。但事实证明,研究蛋白激酶之间的相互作用极其复杂。Bowler说, 这些蛋白激酶是非常动态的分子;它们传递重要信号,需要迅速行动。就p38 而言,它必须进入细胞核并激活许多其他不同的蛋白。
MKK6-p38 复合物的相互作用无法通过大分子晶体学来确定,这阻碍了他们的研究。大分子晶体学是一种结构生物学技术,通常用于研究蛋白,但在研究这类动态蛋白时尤其具有挑战性。
低温电镜(cryo-EM)的最新发展,尤其是近十年来的发展,带来了新的希望。2016年,Bowler和论文第一作者Pauline Juyoux决定改用这种技术---尽管当时认为这种蛋白复合物太小,不适合低温电镜分析。他们得到了Pellegrini的支持,后者已经掌握了这种技术的专业知识。
坚韧和协作是项目成功的关键因素。Juyoux回忆说, 虽然经历了很多波折,但总有鼓舞人心的人或时刻,其中一个尤为难忘。2017年低温电镜获得诺贝尔奖的同一天,我们获得了第一个低分辨率三维负染色模型。这给了我们很大的动力!
利用欧洲同步辐射设施(European Synchrotron Radiation Facility)和钻石光源(Diamond Light Source)的低温电镜和补充技术,如X射线晶体学和小角X射线散射(small-angle X-ray scattering, SAXS),这些作者成功获得了MKK6-p38 复合物的三维结构,并确定了一个之前未知的对接位点,在这个对接位点上这两种酶相互作用---这对于理解p38 如何被激活至关重要。
Juyoux解释说, 这可能是开发抑制剂的一个有趣靶标,抑制剂可以阻断这种特定的相互作用,从而阻断引发炎症反应的信号。
Bowler、Pellegrini 和 Juyoux 与日内瓦大学的 Francesco Luigi Gervasio实验室开展了分子动力学模拟合作,进一步了解了这两种蛋白激酶是如何相互作用的。
Juyoux解释说, 他们的研究表明,我们生成的结构模型与酶活性相符,而且磷酸化位点与活性位点的距离合适。他们还对MKK6-p38 复合物的不同构象类型进行了分类,以显示它们是如何组装的。
最重要的是,通过将这些模拟与 SAXS 数据进行比较,他们能够模拟这两种蛋白在催化之前是如何相互作用的。Gervasio解释说, 通过先进的方法将最先进的模拟与SAXS和低温电镜数据结合起来的好处在于,我们可以 看到 这两种激酶相互接近的舞姿,同时知道我们在计算机中看到的东西完全得到了所有可用实验数据的支持。
他继续说, 这些模拟需要几个月的超级计算时间,由瑞士国家超级计算中心慷慨提供,但考虑到最终结果的相关性,这一切都是值得的。
这些结果提供了一个可供选择的值得探索的药物靶标,也为研究其他两个MAP激酶家族---涉及癌症的ERK激酶和也涉及炎症尤其是的JNK激酶---的类似过程打开了大门。
Juyoux说, 蛋白激酶在序列和结构上非常相似,但我们不知道它们如何以及为什么会做出反应或发出特定信号。比较这些不同的蛋白激酶家族有助于解释相互作用的特异性,并引领新的治疗方法。 ( 100yiyao.com)
参考资料:
1. Pauline Juyoux et al. . Science, 2023, doi:10.1126/science.add7859.
2. Switching off the cytokine storm
https://www.embl.org/news/science/switching-off-the-cytokine-storm/
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature Materials:清华大学喻国灿/程功等开发新型LNP,不在肝脏蓄积,让mRNA疫苗更安全、更高效 (2025-08-06)
- Nature头条:超加工食品让减肥更加困难,还会影响心血管代谢健康 (2025-08-06)
- 北京生命科学研究所发表最新Cell论文 (2025-08-06)
- STM:中山大学团队找到肠癌“照妖镜”,首次发现抑制SIRT2可以让肠癌细胞“现身”! (2025-08-05)
- Nature:王者换代?AI设计的OpenCRISPR-1正式挑战Cas9霸主地位,开启基因编辑新范式 (2025-08-05)
- Cell:顾名夏/苗一非/郭敏哲团队,在同一个球状体中实现肺和肠道类器官的血管化,成功构建多谱系类器官 (2025-08-05)
- 《细胞》:中美团队首次发现,分泌蛋白AOAH可以解除肿瘤对T/树突细胞的免疫抑制! (2025-08-05)
- Nature子刊:仅仅看到病人,大脑就会激活免疫系统,让身体提前做好防御准备 (2025-08-04)
- 困扰韦东奕的牙周问题有救了?王松灵院士团队发表牙髓干细胞治疗牙周炎的临床试验数据 (2025-08-04)
- Cell子刊:赖仞团队揭示高脂饮食通过肠道细菌促进血栓形成的新机制 (2025-08-04)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















