Science |
 |

基于Nabeel Bardeesy研究团队前期开发和制备的mIDH1肝内胆管癌小鼠模型,研究人员发现靶向mIDH1的抑制剂在免疫功能完好的小鼠中能有效抑制肿瘤生长,而在免疫缺陷的小鼠中抑癌效果甚微,这表明抗肿瘤免疫反应在其中起了重要作用【6】。Nabeel Bardeesy和Robert Manguso实验室基于这些发现开展合作研究去解析这些靶向mIDH1药物的具体作用机制。先前的研究表明,mIDH1肿瘤细胞由于DNA高甲基化对T细胞分泌的干扰素IFN 不敏感,mIDH1抑制剂可恢复其对IFN 的敏感性【6】。
在该研究中,研究人员进一步探索发现 mIDH1抑制竟会诱发肿瘤细胞中内源性逆转录病毒和其他转座子(TEs)的重新表达。这些通常被转录沉默的病毒感染元件在mIDH1抑制所伴随的DNA大规模去甲基化中被重新激活。更有意思的是,其中一些TEs含有完整的病毒基因并编码反转录酶等病毒蛋白。这些反转录酶在肿瘤细胞中的上调表达导致了细胞质中dsDNA的产生和积累,这些dsDNA被细胞质中的dsDNA受体cGAS捕获,激活 病毒模拟 反应,使得肿瘤细胞如同被病毒感染的细胞一样产生干扰素等细胞因子以激活免疫系统。
利用小鼠肝内胆管癌模型,研究人员发现mIDH1抑制引发了快速且剧烈的DNA去甲基化,随之而来的是肿瘤细胞增殖减缓和CD8+T细胞浸润增加。转录组分析显示,在mIDH1抑制的早期,肿瘤细胞就上调了免疫刺激I型干扰素和病毒响应基因程序。此外,研究人员发现mIDH1肝内胆管癌及脑胶质瘤中cGAS基因启动子高甲基化而使其表达沉默,导致先天免疫信号相关程序的缺陷。mIDH1抑制引发的大规模DNA去甲基化解除了cGAS和TEs的先天抑制。由TEs编码的反转录酶产生的dsDNA激活了cGAS-STING-IRF3信号,触发了病毒模拟和免疫监视程序,加之mIDH1抑制又能够恢复肿瘤细胞对IFN 的响应,综合导致了强有力抗肿瘤免疫反应。
值得注意的是,在大部分mIDH1实体肿瘤中cGAS基因都被转录沉默,这表明下调cGAS-STING先天免疫信号通路以规避免疫激活是mIDH1肿瘤的特征之一。相应地,缺乏cGAS-STING通路或内源性逆转录病毒反转录酶活性的肿瘤对mIDH1抑制没有响应。至此,研究人员揭示了mIDH1通过表观遗传机制抑制先天免疫,并将内源性反转录酶活性与美国食品药品局()批准的抗肿瘤药物的作用机制联系起来。基于该研究的发现,研究人员提出开发能够增强病毒模拟和/或利用其介导的免疫刺激效应的策略或许可以进一步改善mIDH1抑制剂的效果。
综上所述,该研究揭示了mIDH1癌症的特征之一是先天免疫感知受损,这是由于胞内dsDNA感受器cGAS高甲基化和表达沉默造成的。该研究结果还表明了mIDH1抑制剂的双重治疗机制,即mIDH1抑制介导的DNA去甲基化引发并诱导了TEs依赖的病毒模拟信号,同时也增强了肿瘤细胞对IFN 的响应和敏感性。该研究也为未来探究mIDH1相关的表观遗传调控的免疫逃逸奠定了基础,并对开发针对增强病毒模拟反应的组合疗法来治疗mIDH1癌症提供了理论支持。
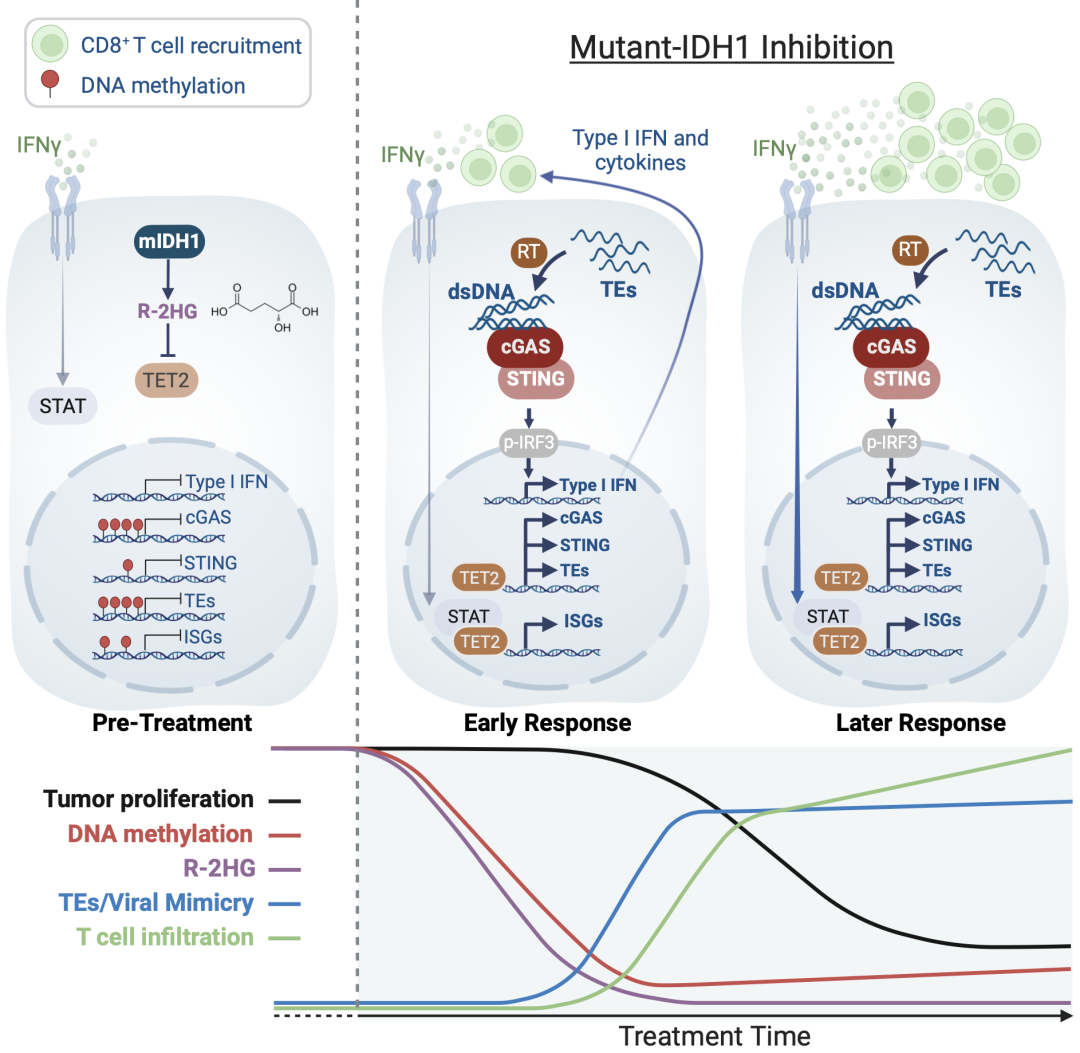
模式图(Credit:Science)
医药网新闻
- 相关报道
-
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 肠道菌群还能操控皮肤炎症?清华大学最新Immunity论文,揭示肠道菌群代谢物驱动银屑病炎症的机制 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















