Mol Cell |
 |

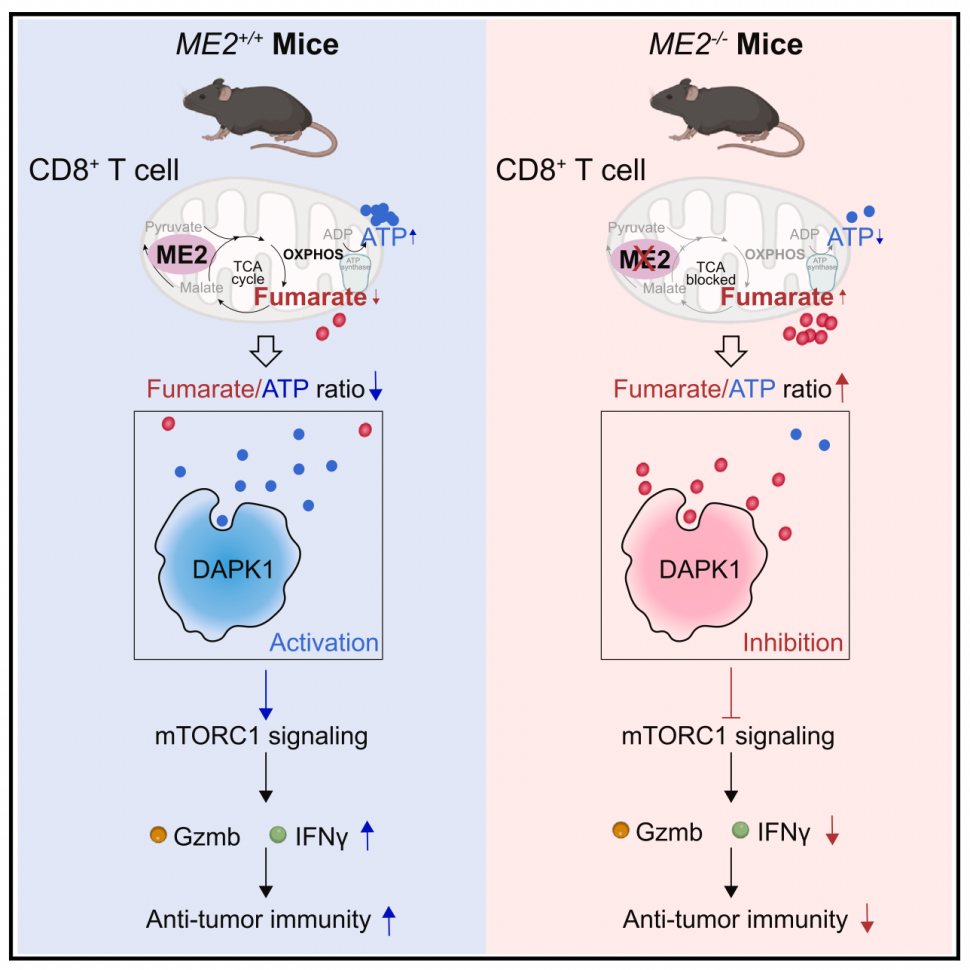
在该研究工作中,研究人员首先构建了苹果酸酶2(ME2)T细胞条件性基因敲除小鼠(CD4-Cre;ME2fl/flmice),发现与野生型小鼠 (ME2 WT)相比,T细胞中缺失ME2 表达的小鼠(ME2 KO)具有较弱的肿瘤抑制能力。通过CD4+ / CD8+ T细胞清除实验和细胞过继实验发现,ME2主要调控CD8+ T细胞(而非CD4+ T细胞)的效应性功能和抗能力。代谢组学和代谢流分析发现,ME2缺失阻断了CD8+T细胞的三羧酸(TCA)循环,导致了TCA中间代谢产物fumarate在细胞内的堆积。
详细的分子机制研究发现,fumarate能够直接结合DAPK1,并通过与ATP竞争结合来抑制DAPK1的激酶活性,从而抑制了其下游的TSC2-mTORC1信号通路,导致CD8+ T 细胞的活化、效应功能和抗肿瘤作用也相应降低。当DAPK1或mTORC1被抑制时,ME2 失去了对CD8+ T细胞抗肿瘤功能的影响。相反,过表达持续活化的DAPK1几乎完全恢复了ME2 缺失的CD8+ T细胞的抗肿瘤能力。这些结果表明,DAPK1是ME2 赋予CD8+ T细胞效应功能和抗肿瘤作用的关键下游靶点,ME2 通过fumarate调控的 DAPK1-TSC2-mTORC1 信号轴调节 CD8+ T 细胞功能。
此外,与之前的研究一致,本研究也发现了fumarate抑制 CD8+ T 细胞的活化和抗肿瘤能力。然而,之前研究发现,fumarate对 T 细胞的抑制作用是通过可逆地抑制参与表观遗传信号转导的二氧酶【6】或通过蛋白质的琥珀酸化修饰实现的【7】。本研究发现fumarate是一种调节 CD8+ T 细胞中 DAPK1 活性的信号分子。fumarate直接与 DAPK1 的 ATP 口袋结合,并通过与 ATP 竞争来抑制 DAPK1 的活性。fumarate对 DAPK1 活性的抑制作用取决于fumarate/ATP 的比例,这表明fumarate可能作为 ATP 拮抗剂来调节 DAPK1 的活性。值得注意的是,先前的一项研究表明,DMF 通过琥珀酸化糖酵解代谢酶GAPDH抑制髓系和淋巴细胞的有氧糖酵解【8】。
然而 ME2 的缺失对 CD8+ T 细胞的糖酵解通并没有影响,这表明 ME2 缺失导致的fumarate积累不会影响糖酵解。因此,虽然fumarate对 T 细胞活化有类似的抑制作用,但其通过不同的机制发挥其功能,这很可能是条件依赖性的。例如,ME2 缺乏导致的fumarate积累水平可能不足以琥珀酸化 GAPDH 来抑制糖酵解,但它可以抑制 DAPK1 的活性,进而抑制 CD8+ T 细胞的活化。因此,该研究表明,DAPK1可能是fumarate的感受器,对细胞fumarate水平的变化更为敏感,从而控制CD8+ T细胞的命运。
模式图(Credit:Molecular cell)
综上所述,本研究发现了ME2 在 T 细胞中的作用,ME2 缺乏会导致fumarate在 CD8+T 细胞中积累,进而通过抑制 DAPK1 来阻碍 mTORC1 信号传导,导致 CD8+ T 细胞的效应功能和抗肿瘤效果受损。值得注意的是,该课题组之前的研究表明,ME2的表达水平和酶活性在T中上调,对T细胞淋巴瘤的发生至关重要【3】,而本研究表明,ME2的生理功能是维持CD8+ T细胞新陈代谢所必需的。这些发现共同凸显了 ME2 在 T 细胞生理和病理过程中的重要性。
医药网新闻
- 相关报道
-
- PNAS:精子也“飙车”?科学家发现能量开关,有望颠覆不孕与避孕未来 (2025-10-16)
- Cell:小胶质细胞-星形胶质细胞交谈调节突触重塑 (2025-10-16)
- 香港西医病院开院首年将提供门诊及日间住院等服务 (2025-10-16)
- 国度药监局对于刊出氯雷他定片等80个药品注册证书的布告 (2025-10-16)
- 《自然·神经科学》:从身到心,一次改善!单剂量裸盖菇素可快速且持续地缓解慢性疼痛小鼠痛觉异常和情绪障碍 (2025-10-16)
- 山东优化养老服务网络 变“养老”为“享老” (2025-10-16)
- Nature Medicine:当新生儿筛查遇上基因组测序,我们准备好了吗? (2025-10-16)
- 颜宁团队连发两篇论文:解析“酷寻”策略发现的全新糖纤维结构,并开发绝对手性判定新算法 (2025-10-16)
- Cell:里程碑式突破!I/IIa期临床试验证实hESC衍生细胞移植可安全并有效地重建帕金森病患者的多巴胺能系统 (2025-10-16)
- 抑郁不只是“情绪感冒”!Science 子刊揭密:大脑糖链“脱落”才是关键,靶向修复或破治疗困局 (2025-10-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















