Nature子刊:中山大学/西湖大学合作揭示多肽的氨基酸组成及拓扑结构对抗炎作用的影响 |
 |
来源:生物世界 2024-08-24 11:35
该研究在天然多肽的启发下,通过人工合成多肽,阐明了其氨基酸组成和拓扑结构对抗炎作用的影响。河南大学陈永明教授、中山大学刘利新教授、西湖大学张越研究员等在NatureNanotechnology上发表了题为:Synthetic polypeptides inhibit nucleic acid-induced inflammation in autoimmune diseases by disrupting multivalent TLR9 binding to LL37-DNA bundles的研究论文。
该研究通过合成多肽,破坏与LL37-DNA束结合的多价TLR9,抑制自身疾病中核酸诱导的炎症。

靶向致病因子是开发新型治疗策略的基础。目前认为,患者血清中异常高水平的细胞外核酸是某些自身免疫疾病的主要发病机制。核酸异常激活Toll样受体(TLR)产生炎性细胞因子,与内源性自身核酸抗体、蛋白质或阳离子人类抗菌肽(例如LL37、HMGB1、HBD3和IL-26)形成的复合物加重自身免疫疾病。
细胞外核酸复合物保护核酸不被脱氧核糖核酸酶(DNase)降解,并促进核酸被免疫细胞内化以刺激TLR。然而,核酸与某些阳离子多肽(例如来自HIV病毒的反式转录激活因子TAT)的复合物不会诱导免疫细胞的炎症反应。TLR的不同行为可以通过LL37-核酸和TAT-核酸复合物的纳米晶体结构来解释。
LL37可以与核酸自组装成具有合适间距(距离约为3.40 nm)的柱状结构,通过多价相互作用与多个TLR9空腔完美匹配,从而激活炎症反应。相比之下,TAT-核酸复合物中的核酸被组织成紧密排列的柱状阵列,对应的核酸间间距约为2.90 nm,远小于TLR9的空间尺寸。因此,TAT-核酸复合物不适合TLR9,对刺激没有贡献。
相对于LL37,TAT在其结构中含有更多连续的精氨酸部分。聚精氨酸的胍(Gua+)单位通过Gua+/PO4-盐桥的形成显示出强的核酸结合。
因此,研究团队推测富含精氨酸的核酸清除剂可以更有效地从它们的核酸复合物捕获核酸,并且新形成的核酸复合物不会通过破坏核酸间的间隔来激活TLR9。此外,考虑到LL37和HMGB1的不同拓扑结构,研究团队进一步探索了阳离子多肽的拓扑结构是否具有不同的抗炎作用。
研究团队利用了两种类型的聚精氨酸,一种是纳米形式(PEG-TK-NPArg),另一种是线性形式(PEG-TK-LArg)。研究团队发现,纳米形式的PEG-TK-NPArg比线性形式的PEG-TK-LArg表现出更强的竞争性亲和力和更有效地阻断核酸诱导的炎症。
为了进一步解释NPArg-核酸复合物不能激活TLR9的原因,研究团队应用小角度X射线散分析了PEG-TK-NPArg-核酸和LL37-核酸复合物的纳米晶体结构。与LL37-NA相比,结构更紧密的PEG-TK-NPArg-核酸与TLR9的空间匹配性较差。随后,在(RA)慢性炎症动物模型中证实了聚精氨酸的抗炎作用。
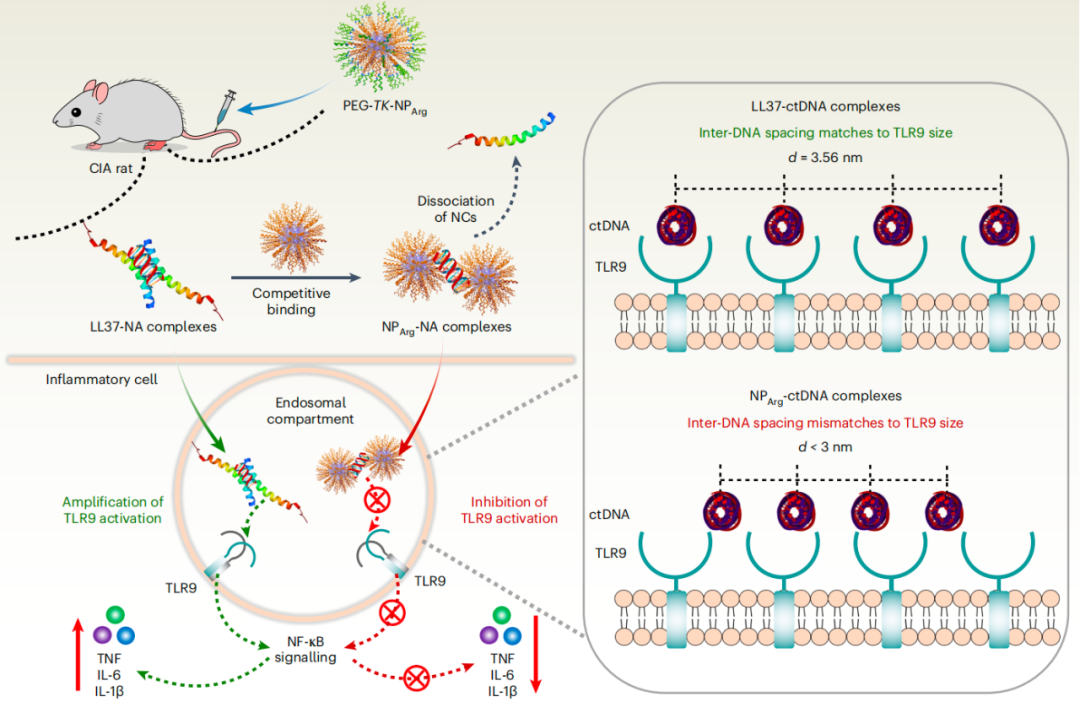
综上所述,该研究在天然多肽的启发下,通过人工合成多肽,阐明了其氨基酸组成和拓扑结构对抗炎作用的影响。因此,该研究提供了阳离子核酸清除剂阻断炎症反应的结构证据,促进了该领域的概念验证研究向临床应用的发展。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 《自然·免疫学》:科学家发现,淋巴结是免疫治疗的引爆点 (2025-10-21)
- Cancer Res:免疫细胞也会“双刀流”?科学家教会抗癌战士新招式,专治耐药肠癌 (2025-10-21)
- 上海德达心血管医院成功举办《胸痛的识别和心脏大血管疾病的规范治疗》研讨会 (2025-10-21)
- 第八届(2025)中国医疗器械创新创业大赛人工智能与医用机器人类别赛圆满落幕 (2025-10-21)
- 上海市下降本市部门医疗服务名目价钱的关照 (2025-10-21)
- 青海省集采药品“三进”种类目次(第一批) (2025-10-21)
- 槲皮素哪个牌子效果好?清肺护肺选什么?长期吸烟该怎么选? (2025-10-21)
- 《自然》:发现燃脂备选方案!科学家首次发现,棕色脂肪中还有一条隐秘的备用燃脂通路,代谢性疾病或迎来治疗新靶点 (2025-10-21)
- Nature子刊:四川大学刘肖珩团队递送miRNA精准调控线粒体代谢,治疗动脉粥样硬化 (2025-10-21)
- Chem Biol Interact新突破:HDAC1抑制剂ZJH-1“精准绞杀”前列腺癌,去势抵抗患者终于等来了新曙光 (2025-10-21)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















