《细胞》子刊:科学家首次发现,肿瘤坏死因子竟会促进树突状细胞凋亡,帮助胰腺癌进展! |
 |
来源:生物世界 2024-09-07 12:00
结果说明,TNF主要是通过TNFR1信号通路来促进PDAC进展的,当敲除Tnfr1或用抗体阻断TNFR1信号时,可增强小鼠肿瘤内T细胞的抗肿瘤免疫反应,减缓肿瘤进展。近期,美国国家癌症研究所Muhammad S.Alam和Jonathan D.Ashwell团队发表了一篇研究,就对TNF促进PDAC进展的机制进行了探讨。
他们发现,TNF可通过其受体TNFR1信号限制树突状细胞(DC)的数量和功能,来促进胰腺肿瘤生长。而基因敲除或用抗体阻断TNFR1信号,可以增加肿瘤内DC的数量,提升它们的抗原呈递能力,进而增强了T细胞的抗肿瘤反应,减缓了胰腺肿瘤的生长。
进一步他们发现,TNF通过TNFR1信号诱导的骨髓来源DC的凋亡,是DC数量和功能受到限制的主要原因。
研究发表在Cell Reports Medicine上[1]。

论文首页截图
鉴于TNF主要是通过它的两个受体(TNFR1和TNFR2)来进行信号传导,于是,为了知道TNF究竟利用哪个通路实现促进PDAC进展的,研究人员构建了PDAC小鼠模型(KPC小鼠,携带Kras突变)。
随后分别向野生小鼠、Tnfr1敲除小鼠和Tnfr2敲除小鼠皮下注射KPC小鼠的,并在35天后观察这些肿瘤的体积和重量。
结果发现,与野生小鼠和Tnfr2敲除小鼠相比,Tnfr1敲除小鼠肿瘤生长明显放缓,肿瘤内浸润免疫细胞数量也明显增加。这些免疫细胞,尤其是CD4和CD8阳性T细胞的活性也明显增强了(表现为IFN- 水平的升高以及T细胞耗竭标志物PD-1表达的减少)。
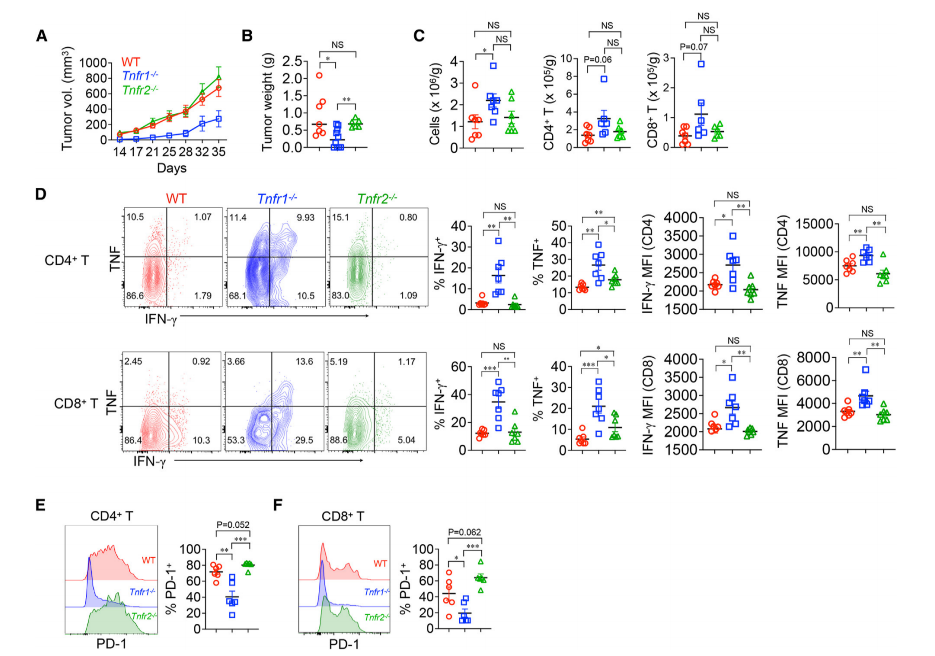
Tnfr1敲除小鼠肿瘤生长明显放缓,T细胞的活性增强
此外,研究人员还测试了用抗体阻断TNFR1信号的效果,得到的结果也与敲除Tnfr1类似,即抗体阻断后,小鼠肿瘤生长明显减缓。
以上结果说明,TNF主要是通过TNFR1信号通路来促进PDAC进展的,当敲除Tnfr1或用抗体阻断TNFR1信号时,可增强小鼠肿瘤内T细胞的抗反应,减缓肿瘤进展。
接下来的T细胞敲除、骨髓移植等一系列实验证实,TNF-TNFR1信号并不是直接作用于T细胞来发挥促癌作用,而是通过限制肿瘤中DC数量和功能,来促进肿瘤的进展。
具体来说,研究人员发现,单独在T细胞中特异性敲除Tnfr1,并不能增强T细胞的抗肿瘤免疫反应。而在骨髓移植实验中,接受Tnfr1敲除骨髓移植的小鼠生存时间明显更长,小鼠肿瘤中DC数量(尤其是DC1和DC2)明显增加,功能也得到了增强(表现为与抗原呈递相关的基因,如CD40表达显著上调),这进一步促进了T细胞的活化和抗肿瘤反应。
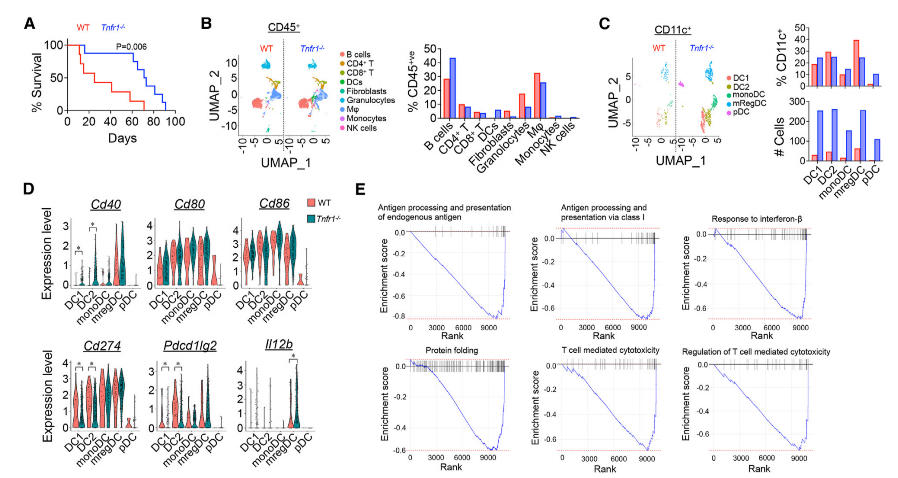
骨髓移植实验,基因表达分析结果
随后的体外实验结果表明,TNF通过TNFR1信号诱导的骨髓来源DC的凋亡,是DC数量和功能受到限制的主要原因。
既往有研究显示,造血因子Flt3L和抗CD40抗体联合使用可以增强KPC小鼠肿瘤内DC数量。在本文中,研究人员比较了Flt3L和抗CD40抗体组合与抗TNFR1抗体在增加DC数量上的差异。结果显示,用抗体阻断TNFR1在增加肿瘤内DC数量和抑制肿瘤生长方面更为有效。
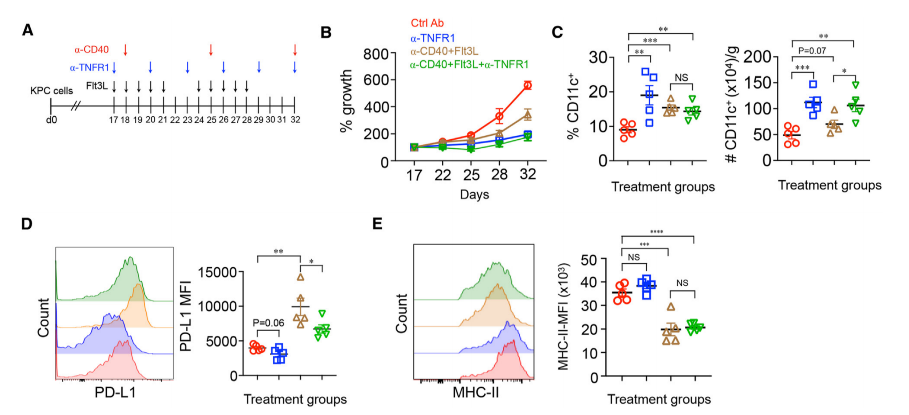
抗TNFR1抗体效果更好
最后,研究人员通过分析临床PDAC样本中的Tnfr1表达和DC数量,发现Tnfr1表达水平与肿瘤内DC数量呈负相关。这表明,与小鼠模型一致,在人体中,TNF也是通过TNFR1信号来抑制DC数量和功能,来发挥促癌作用。
综上,该研究发现,TNF可通过TNFR1信号,限制DC数量和功能来促进PDAC进展。鉴于在PDAC肿瘤微环境中,DC数量减少是导致免疫逃逸的关键,未来靶向TNFR1信号通路可能是增强抗肿瘤免疫反应的有效策略。这一研究结果也为开发新的PDAC治疗方法提供了理论基础。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 警惕“超级大肠杆菌”!它堵死肠道细胞“自我牺牲路”,新研究破解抗耐药密码 (2025-10-27)
- Nature Genetics:我们沿用20年的小鼠参考基因组,究竟错过了什么?一份T2T图谱的完整答案 (2025-10-26)
- 情感传染!南方医科大学最新论文登上Science封面 (2025-10-26)
- Nature Biotechnology:数据基准与算法创新的双轮驱动——DeepSomatic研究定义的基因组学发现新范式 (2025-10-25)
- Nature:当饥饿遇上荷尔蒙——大脑如何权衡母爱与生存? (2025-10-25)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 《柳叶刀》:减肥神药,暗藏护心秘法!迄今最大规模临床试验证实,司美格鲁肽的心脏保护作用与基线肥胖和体重减轻无关,或有独特保护机制 (2025-10-24)
- Cell子刊:脂肪细胞脂解,激活上皮干细胞,促进毛发再生 (2025-10-24)
- AJPCP:线粒体钾通道调节棕色脂肪组织的产热,为新的肥胖治疗铺平道路 (2025-10-24)
- 生育力下降别只怪卵子!Science:卵巢里的神经、胶质细胞才是“隐形操控者” (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















