Immunity:组织驻留Treg——定植特化模型vs 泛组织模型 |
 |

团队首先在小鼠的48个组织中分析Treg的浸润和表型,包括淋巴、非淋巴和肠相关组织。结果发现Treg在各组织占CD4+T细胞的10-20%,在骨髓、皮肤和舌头占比上升到50%。在绝对数量上,淋巴组织Treg为104-107,肠相关组织为103-105,非淋巴组织为10-104。整体上看,淋巴组织Treg占机体Treg的98%,肠相关组织为0.8%,非淋巴组织为0.3%。
流式降维分析将Treg分为5群,包括血液、淋巴、骨髓、组织和肠相关Treg,这种分群大致反应解剖位置,但也存在例外如胃Treg聚类到组织Treg。进一步分析发现组织Treg基本为活化和CD69+Treg,包括ST+和KLRG1+群。值得注意的是,这些表型在不同组织间基本无差别。总之,这些数据表明几乎所有组织存在Treg,且在非淋巴非肠道组织Treg表型相似。随后,作者探究性别、年龄和肠道菌群对组织Treg的影响。结果发现Treg表型在雌雄之间几乎无差别,除了雌性唾液腺Treg增加而雄性白色脂肪Treg增加;而组织Treg在老龄小鼠中增加5-20倍,增加最多的是白色脂肪组织和肝脏。除了白色脂肪组织和肌肉,Treg占CD4+T细胞的比例基本稳定,表明Treg的增加可能是由于整体CD4+T细胞的炎性扩增;除了骨髓和肠道粘膜固有层趋势相反,大部分组织Treg随肠道菌群复杂性增加而增加。Treg表型除了ICOS表达随菌群复杂性增加而增加外其余表达稳定。这些数据表明组织Treg数量受年龄和肠道菌群影响,但Treg表型较为稳定。
作者分离各个组织Treg行RNA-seq分析,包括血液、淋巴组织(脾脏、淋巴结和派氏结)、肠相关组织(上皮间白细胞和黏膜固有层)和非淋巴非肠道组织(肝、肺、胰腺和肾)。结果表明肠相关Treg和非淋巴组织Treg在转录组上相似,且各个非淋巴组织Treg也呈现高度相似特征。之后,团队分析组织驻留相关基因,包括CD69、ST2、KLRG1、CD103、Blimp、BATF、CD11a、S1PR2、Areg和HIF1 ,对组织Treg的影响。通过WT小鼠和上述基因缺失小鼠构建1:1嵌合小鼠,作者发现除了Blimp和BATF3,其余组织浸润相关基因对组织Treg影响较小,且观察到的差异也是泛组织而非组织特异。这些结果说明组织Treg不仅有统一的表型,同时也分享相同的组织驻留关键分子。
这种表型和分子依赖的相似性是由于Treg的多样性被抑制还是组织驻留时间有限?为此,作者构建多时间点的CD45.1-CD45.2 parabiosis模型,结果发现在淋巴组织,CD69+Treg在淋巴结停留3天,脾脏17天、肠系膜淋巴结4周;在非淋巴组织,CD69+Treg平均停留3周,白色脂肪组织则达到8周;肠相关Treg停留时间为7-8周。在平均停留3周后,大多数CD69+Treg离开组织。总之,这些结果表明组织驻留Treg在组织停留时间较短,并支持活化Treg进入-短暂停留-离开的循环迁移模型。
尽管上述数据不支持Treg的长期驻留,但仍可能存在两种情况。1. 克隆限制的循环迁移,即克隆限制Treg在一个组织和淋巴组织之间循环迁移。2. 泛组织迁移模型,即Treg在多个组织循环迁移。作者首先评价组织Treg的TCR克隆性,结果发现非淋巴组织驻留Treg具有高度克隆共享。相反,肠黏膜固有层Treg的TCR在非肠道组织很少观察到。随后,作者挑选组织Treg的TCR并通过编码联合逆转录病毒对造血进行逆基因再表达并过继入小鼠体内,发现60%逆基因再表达细胞分化为Treg且大部分Treg均遵循泛组织迁移模型,仅少数TCR有组织特异性分布倾向。总之,这些数据支持泛组织Treg迁移驻留模型。
综上所述,这项研究揭示组织间Treg表型和TCR相似且定居时间较短,并提出组织驻留Treg的泛组织迁移模型,为组织驻留Treg的认知提供另一种理解。
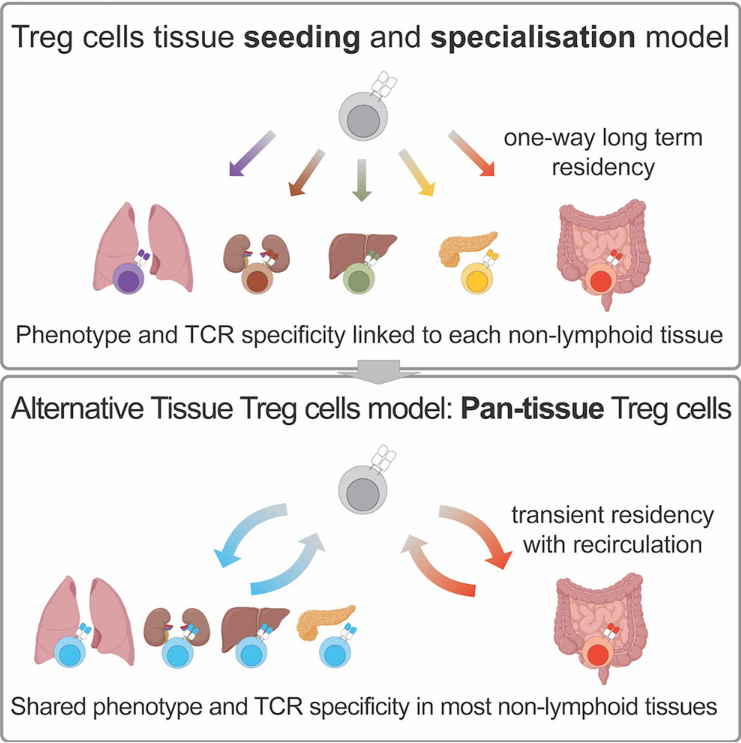
模式图(Credit:Immunity)
医药网新闻
- 相关报道
-
- 屡获殊荣:诺华川西南林业碳汇项目荣获《南方周末》2025年度ESG创新案例奖 (2025-07-28)
- 一滴血测早期食管癌!Adv Sci:新型生物芯片结合AI,9种囊泡蛋白助诊断准确率超90% (2025-07-28)
- Science:利用新开发的谱系追踪工具绘制肿瘤细胞的历史和位置,从而揭示其生长模式 (2025-07-28)
- Cell:新研究确定了世界上首个有望预防危及生命的HTLV-1病毒感染的新方法 (2025-07-28)
- 华人学者本周发表6篇Cell论文:逆转阿尔茨海默病、软骨再生、先导编辑疗法、卒中后大脑炎症、人类蛋白质组衰老图谱 (2025-07-28)
- Nature子刊:曾木圣/张华/孙聪团队发现首个EB病毒感染上皮细胞的主要受体 (2025-07-28)
- Cell:新研究表明拉帕司他有望治疗隐孢子虫感染 (2025-07-28)
- Trends Neurosci最新综述:腹侧被盖区(VTA)——压力下的“情绪指挥家” (2025-07-27)
- 不顾作者强烈抗议,Science期刊撤稿了这篇15年前发表的颠覆性论文,“砷基生命”尘埃落定 (2025-07-27)
- Science:一种经过改造的肠道细菌有望对抗肾结石 (2025-07-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















