研究发现细菌精氨酸激酶的内源激活机制 |
 |
来源:网络 2024-10-06 15:37
本研究首次报道了金黄色葡萄球菌的McsA-McsB复合物的冷冻电镜结构。结果显示McsB的四个亚基占据中心位置,形成一个夹层二聚体。蛋白质的磷酸化是一种由激酶和磷酸酶介导的可逆蛋白质翻译后修饰(Protein translational modification, PTM)过程。这一动态修饰过程在新陈代谢、转录、分化以及细胞间通讯等细胞生命的几乎所有方面都发挥着重要作用。蛋白激酶在这种调控机制中扮演着核心角色,它们催化ATP的 -磷酸向蛋白质底物的氨基酸侧链转移,从而实现关键的磷酸化过程。在众多蛋白激酶当中,McsB是革兰氏阳性菌中目前已知的唯一一种精氨酸磷酸化激酶。
其主要参与了细菌蛋白质功能和稳定性的动态调控。在热应激条件下,McsB与激活蛋白McsA结合后能够有效磷酸化热休克转录调节因子CtsR,CtsR的磷酸化修饰是解除其对clpC启动子转录抑制的关键步骤,这一修饰激活了蛋白质质量控制系统核心组件的转录和表达,从而降解细菌中因热应激产生的变性蛋白质。
在这一过程中,金属蛋白McsA能够结合McsB,增强其激酶活性,这一事实已经被广泛报道,但有关McsA-McsB复合物的结构基础以及McsA如何激活McsB使底物CtsR发生磷酸化动态修饰的分子机制仍然未知。解析McsA激活McsB的分子机制,有助于深入研究细菌在热压力下如何利用磷酸化动态修饰维持蛋白质稳态,并基于此开发针对性的干预药物,将为抗菌治疗提供新的思路和理论依据。
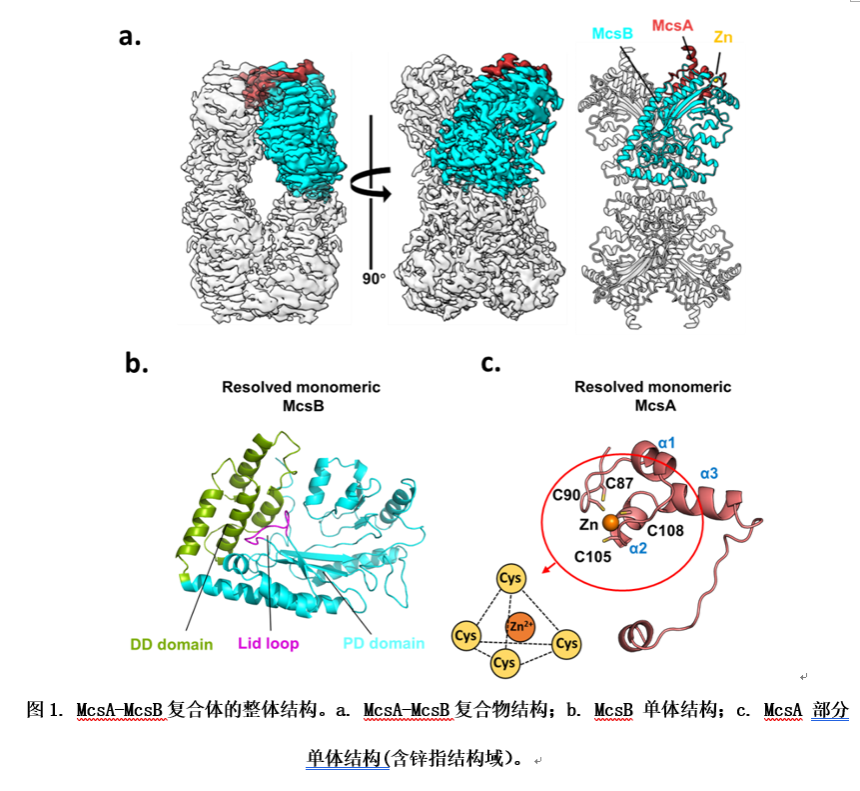
近日,中山大学的毛宗万教授、夏炜教授和四川大学华西医院的苏昭铭教授合作,首次报道了金黄色葡萄球菌的McsA-McsB复合物的冷冻电镜结构。结果显示McsB的四个亚基占据中心位置,形成一个夹层二聚体。两个二聚体之间有 30 的旋转角,暴露出激酶的活性位点。每个McsA亚基位于复合物的四个远端分别利用一个锌指结构域及两个 螺旋与一个McsB单体相互作用,从而形成4 McsA-4 McsB的复合物形式。若破坏该锌指结构域,则McsA无法结合McsB,进而无法激活McsB。揭示了锌离子在维持McsA正常结构及其与McsB相互作用中的重要作用。
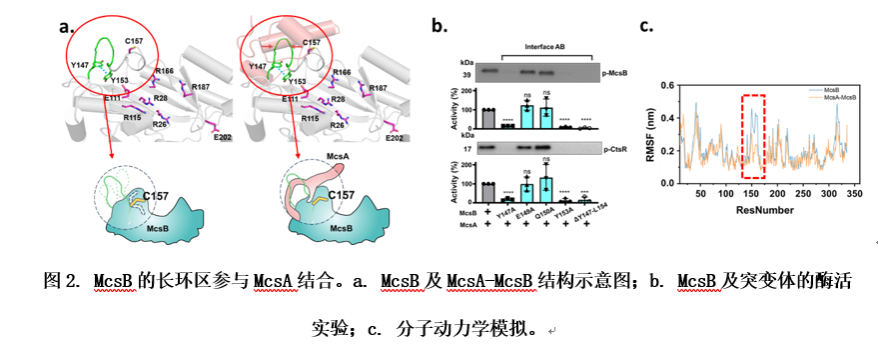
观察McsB与McsA的相互作用面可知,McsB通过一段长环区与McsA的锌指结构域和两个 螺旋完成相互作用。在单独的McsB中,McsB长环区主要通过两个酪氨酸残基Y147和Y153形成典型的T型 - 堆积,以保持稳定。值得注意的是,催化残基之一的C157位于同一环区。若破坏该 - 堆积,则会扰乱催化残基C157的朝向,最终导致McsB完全丧失激酶活性。由于McsB长环区的构象对其激酶活性的关键作用,研究者推测McsA结合可能会稳定该环区,从而固定催化残基C157的朝向,进而加强McsB对CtsR的磷酸化修饰活性。
为了验证假设,研究者对McsB和McsA-McsB复合物结构进行了分子动力学(Molecular Dynamics,MD)模拟。RMSF分析表明,与McsA-McsB复合物结构相比,McsB的一个区域(残基I145-G164)的柔性大大增强。这一柔性区域包括McsB长环区域(残基Y147-L154)和关键的催化残基(Cys157)。这些发现揭示了McsA在稳定和限制McsB长环区和保守催化Cys残基的动态行为中的关键作用。
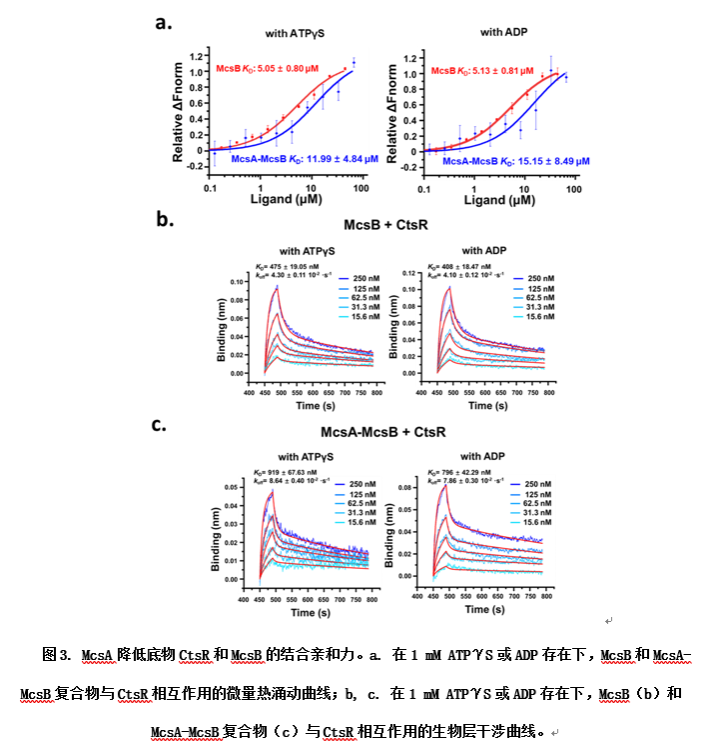
此外,结构信息显示McsA的结合位点接近McsB的底物结合口袋,表明McsA可能会干扰McsB和底物CtsR之间的相互作用。研究者通过微量热涌动(Microscale Thermophoresis,MST)和生物层干涉(Bio-Layer Interferometry,BLI)等实验表明,McsA的结合会降低McsB对CtsR的结合亲和力。重要的是,这种亲和力的降低主要体现在解离速率的增加,表明了McsA的结合加速了磷酸化CtsR的离去速率从而加快了反应循环。
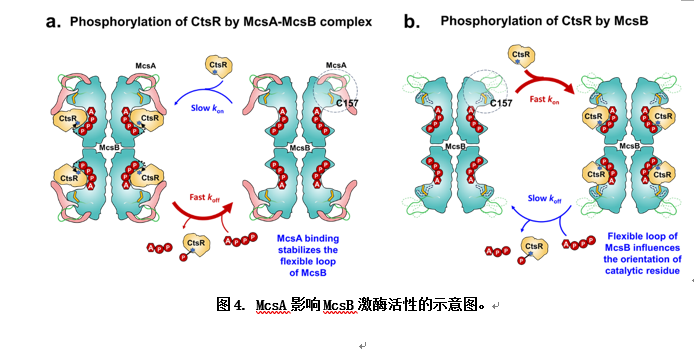
此项工作首次解析了激酶复合物McsA-McsB的冷冻电镜结构,揭示了McsA通过锌指结构域及 螺旋与McsB结合,稳定了McsB的关键催化半胱氨酸残基C157并显著降低了底物蛋白CtsR与McsB的结合能力,加速磷酸化CtsR的离去速率,从而增强McsB的精氨酸激酶活性,实现对CtsR的磷酸化修饰。这种磷酸化修饰通过McsA激活McsB后对CtsR的调控,使得CtsR的抑制作用得以解除,从而迅速响应环境变化,有效维持了细胞内蛋白质的质量和功能稳定。
相关研究成果发表在Nature Chemical Biology期刊上。化学院博士研究生卢开和陶璇以及四川大学华西医院研究助理罗炳男为该论文的共同第一作者,四川大学华西医院的苏昭铭教授、中山大学化学学院的夏炜教授和毛宗万教授为该论文的通讯作者。该研究工作受到了国家、国家重点研发计划项目、中央高校基本科研业务费专项资金和四川大学启动资金等项目的支持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 屡获殊荣:诺华川西南林业碳汇项目荣获《南方周末》2025年度ESG创新案例奖 (2025-07-28)
- 一滴血测早期食管癌!Adv Sci:新型生物芯片结合AI,9种囊泡蛋白助诊断准确率超90% (2025-07-28)
- Science:利用新开发的谱系追踪工具绘制肿瘤细胞的历史和位置,从而揭示其生长模式 (2025-07-28)
- Cell:新研究确定了世界上首个有望预防危及生命的HTLV-1病毒感染的新方法 (2025-07-28)
- 华人学者本周发表6篇Cell论文:逆转阿尔茨海默病、软骨再生、先导编辑疗法、卒中后大脑炎症、人类蛋白质组衰老图谱 (2025-07-28)
- Nature子刊:曾木圣/张华/孙聪团队发现首个EB病毒感染上皮细胞的主要受体 (2025-07-28)
- Cell:新研究表明拉帕司他有望治疗隐孢子虫感染 (2025-07-28)
- Trends Neurosci最新综述:腹侧被盖区(VTA)——压力下的“情绪指挥家” (2025-07-27)
- 不顾作者强烈抗议,Science期刊撤稿了这篇15年前发表的颠覆性论文,“砷基生命”尘埃落定 (2025-07-27)
- Science:一种经过改造的肠道细菌有望对抗肾结石 (2025-07-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















