Mol Cell:OPA1协调线粒体ROS和整合应激反应调控细胞铁死亡 |
 |

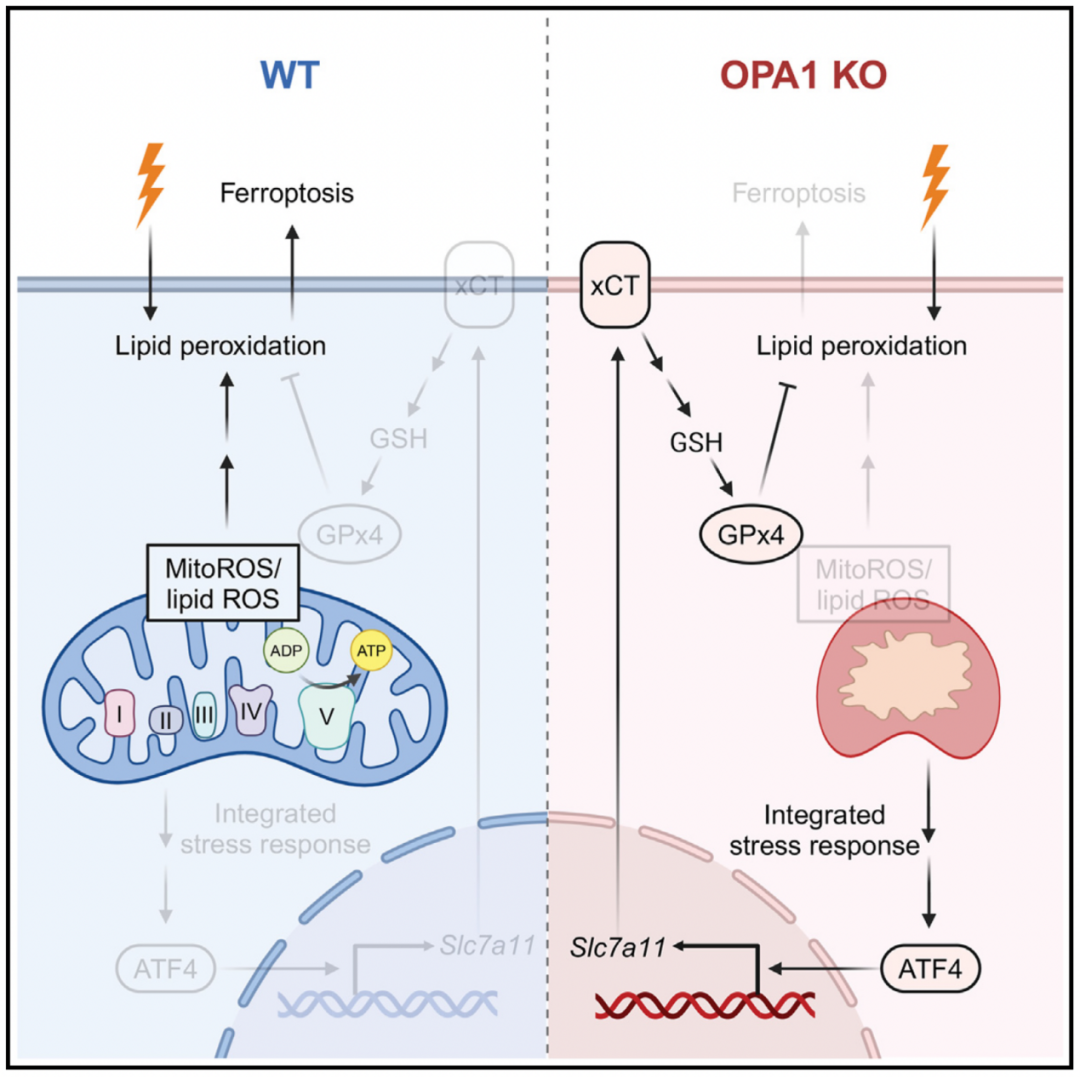
OPA1是一种线粒体动力蛋白样GTP酶,负责线粒体形态发生、融合和能量动力学。鉴于OPA1在控制线粒体结构和能量方面的作用,作者推测OPA1可能是通过线粒体依赖机制来调节铁死亡的关键节点。为了研究OPA1在铁死亡中的作用,作者使用了小鼠胚胎成纤维细胞(MEFs)和人类U2OS细胞,并在这两种细胞中分别敲除Opa1,通过三种方法(半胱氨酸剥夺、小分子抑制剂诱导和脂质过氧化检测)诱导铁死亡。研究发现,OPA1的缺失可以显著减少脂质过氧化和由多种铁死亡诱导剂引起的细胞死亡。这表明OPA1可能是铁死亡的一个正调控因子,在铁死亡中起到促进作用。此外,OPA1的GTPase活性在这个过程中十分重要,GTPase功能缺陷突变体(K301A)不能拯救Opa1缺失导致的铁死亡抑制。
研究人员进一步的机制研究发现,OPA1促进铁死亡的能力与其促进线粒体融合的能力无关,因为在缺失Opa1的细胞中表达L-OPA1(具有促进线粒体融合能力)和S-OPA1(不具有促进线粒体融合能力)两种异构体时,所有细胞的死亡率相似,脂质过氧化水平也无显著差异。除了介导线粒体融合外,OPA1还调控线粒体嵴的超微结构、电子传递链复合物(ETC)的组装以及氧化磷酸化。因此,缺失Opa1导致线粒体嵴的结构混乱和ETC I、III、IV和V的组装受损,但不影响复合物II的组装。有趣的是,OPA1在通过半胱氨酸剥夺和xGT抑制剂(erastin)导致的线粒体ROS和脂质ROS积累中发挥作用,而在通过GPx4抑制剂(RSL3)引发的ROS积累中不发挥作用。这种差异性解释了为什么Opa1缺失的MEFs对erastin诱导的铁死亡比对RSL3更具抗性。
为了理解OPA1缺失如何赋予细胞对铁死亡的抗性,研究人员接下来探究了OPA1缺失是否影响xCT-GSH-GPx4通路。研究发现,OPA1的缺失上调了xCT基因的转录和活性,进而GSH水平也得到提升。更加重要的是,OPA1缺失细胞表现出更高的GPx4蛋白水平,并在erastin和RSL3处理期间GPx4水平并没有很快的下降,这与细胞对铁死亡的抗性一致。敲低xCT基因使得OPA1缺失细胞对铁死亡的抗性消失,细胞重新变得对铁死亡敏感。这些结果表明,OPA1缺失通过上调xCT-GSH-GPx4通路赋予细胞对铁死亡的抗性。研究人员随后通过RNA-seq分析发现,ATF4转录因子是整合应激反应的关键转录激活因子,能够上调一些铁死亡抗性相关基因(如xCT基因)的表达,OPA1的缺失导致ATF4表达上调以及整合应激反应的激活。
文章的最后,作者还探究了OPA1对脂质代谢的影响。通过脂质组学分析,磷脂、溶血磷脂、甘油酯、游离脂肪酸和鞘脂在OPA1缺失的细胞中表现出显著变化。其中,多不饱和脂肪酸的某些种类表现出减少的现象,大多数单不饱和脂肪酸则显著富集。多不饱和脂肪酸在铁死亡过程中特别容易发生过氧化,而单不饱和脂肪酸可以减少细胞膜上脂质过氧化的积累,这表明单不饱和脂肪酸的积累可能在抑制铁死亡中发挥了潜在作用。
模式图(Credit:Molecular Cell)
医药网新闻
- 相关报道
-
- 屡获殊荣:诺华川西南林业碳汇项目荣获《南方周末》2025年度ESG创新案例奖 (2025-07-28)
- 一滴血测早期食管癌!Adv Sci:新型生物芯片结合AI,9种囊泡蛋白助诊断准确率超90% (2025-07-28)
- Science:利用新开发的谱系追踪工具绘制肿瘤细胞的历史和位置,从而揭示其生长模式 (2025-07-28)
- Cell:新研究确定了世界上首个有望预防危及生命的HTLV-1病毒感染的新方法 (2025-07-28)
- 华人学者本周发表6篇Cell论文:逆转阿尔茨海默病、软骨再生、先导编辑疗法、卒中后大脑炎症、人类蛋白质组衰老图谱 (2025-07-28)
- Nature子刊:曾木圣/张华/孙聪团队发现首个EB病毒感染上皮细胞的主要受体 (2025-07-28)
- Cell:新研究表明拉帕司他有望治疗隐孢子虫感染 (2025-07-28)
- Trends Neurosci最新综述:腹侧被盖区(VTA)——压力下的“情绪指挥家” (2025-07-27)
- 不顾作者强烈抗议,Science期刊撤稿了这篇15年前发表的颠覆性论文,“砷基生命”尘埃落定 (2025-07-27)
- Science:一种经过改造的肠道细菌有望对抗肾结石 (2025-07-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















