《自然·免疫学》:先天免疫,真是好样的!科学家首次发现,炎症小体竟能通过激活DNA损伤反应抗癌 |
 |
《自然·免疫学》:先天免疫,真是好样的!科学家首次发现,炎症小体竟能通过激活DNA损伤反应抗癌
来源:奇点糕 2024-10-18 10:06
Si Ming Man团队这项研究成果让我们对先天性免疫、DNA损伤感受/响应和癌症发生发展之间有了新认知。此外,这一发现有望带来新的抗癌靶点,为癌症的防治带来新希望。由澳大利亚国立大学Si Ming Man领衔的研究团队,在著名期刊《自然 学》上发表一项重要研究成果。
他们首次发现,炎症小体蛋白NLRC4,竟然还有一种独特的非炎症抗癌功能。具体来说,NLRC4会通过组建一个独特的蛋白复合体激活DNA损伤反应,减轻DNA损伤的积累,进而抑制癌症的发生或进展[1]。
从研究结果来看,NLRC4可能是唯一能有效防止肿瘤发生/发展的炎症小体蛋白。这一发现也为癌症的防治指出了新方向。

▲论文首页截图
说起炎症小体,大家应该不会陌生。
它是先天免疫系统的重要组成部分。作为一种模式识别受体,它可协调宿主对感染和自身炎症性疾病的反应。
以本研究涉及的NLRC4来说,它主要负责识别细菌鞭毛蛋白和III型分泌系统的成分。在被激活后,NLRC4不仅会通过下游一系列分子,促进细胞因子的产生,诱发炎症,还可以诱导细胞焦亡,进而抑制感染的发生和进展。
不过,近年来,有些研究发现炎症小体似乎还有一些非炎症/非免疫相关的功能。为了进一步探究炎症小体蛋白的其他功能,Si Ming Man团队以抑癌蛋白APC突变驱动的癌症小鼠模型,全面探索了炎症小体与癌症之间的关系。
在研究一开始,Si Ming Man团队分别构建了五个炎症小体缺失的Apcmin/+小鼠模型,并观察与Apcmin/+小鼠相比,另外五种小鼠模型的肿瘤负担情况。
从结果来看,只有Apcmin/+Nlrc4-/-小鼠在20周龄时,小肠中肿瘤的数量比Apcmin/+鼠显著增加。其他炎症小体缺失小鼠的肿瘤负担与Apcmin/+小鼠相比均没有显著性差异。
随后,研究人员还从多个角度比较了不同小鼠模型肿瘤的情况。最后证实,限制肿瘤发生的炎症小体蛋白是NLRC4,而不是NLRP3、NLRP6、AIM2和caspase-11。
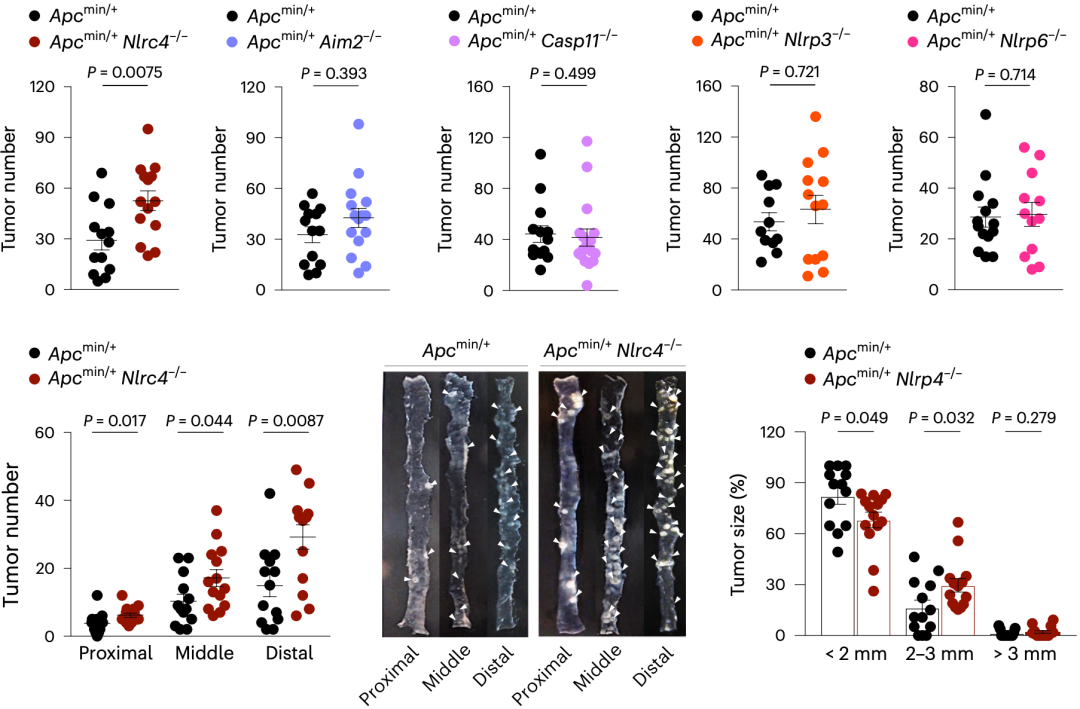
▲仅炎症小体NLRC4缺失影响肿瘤小鼠负担
由于NLRC4是炎症小体,Si Ming Man团队很自然想到,NLRC4缺失带来的抗肿瘤效果,会不会是因为炎症反应受到影响导致的。
大量研究结果表明,在这个肿瘤小鼠模型中,NLRC4缺失的抗癌作用与NLRC4的促炎作用无关,甚至与它这个家族中已知的促炎信号均无关。
这一发现激发了研究人员的好奇心。
考虑到APC是通过促进转录因子 -catenin的降解,从而抑制细胞增殖和肿瘤发展。因此,他们想知道NLRC4缺失的抗癌作用是不是与 -catenin有关。
研究结果又让Si Ming Man团队大失所望 -catenin没受影响。这一下子就失去了研究方向。
为了揭开背后的谜团,他们开展了系统性的磷酸化蛋白质组质谱分析。
在分析结果时,他们发现,在Apcmin/+Nlrc4-/-小鼠和Apcmin/+小鼠之间,差异最大的是与辐射响应和紫外线响应相关的蛋白。这说明,炎症小体NLRC4与DNA损伤之间存在潜在联系。
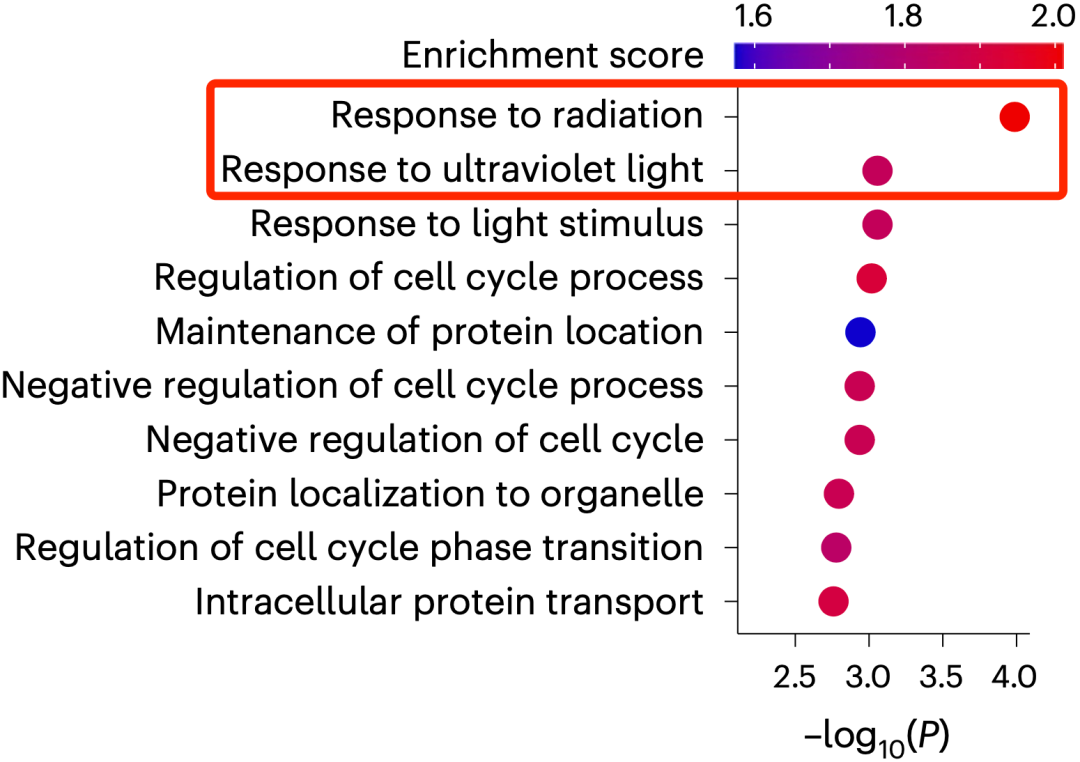
▲NLRC4与DNA损伤之间的关系浮出水面
随后,Si Ming Man团队检测了DNA损伤标志物 H2AX的水平。
确实,他们发现与Apc+/+小鼠相比,Apcmin/+小鼠的小肠中含有更多的 H2AX阳性细胞,而Apcmin/+Nlrc4-/-小鼠的 H2AX阳性细胞更多。
这表明NLRC4可减轻细胞中DNA损伤的积累。
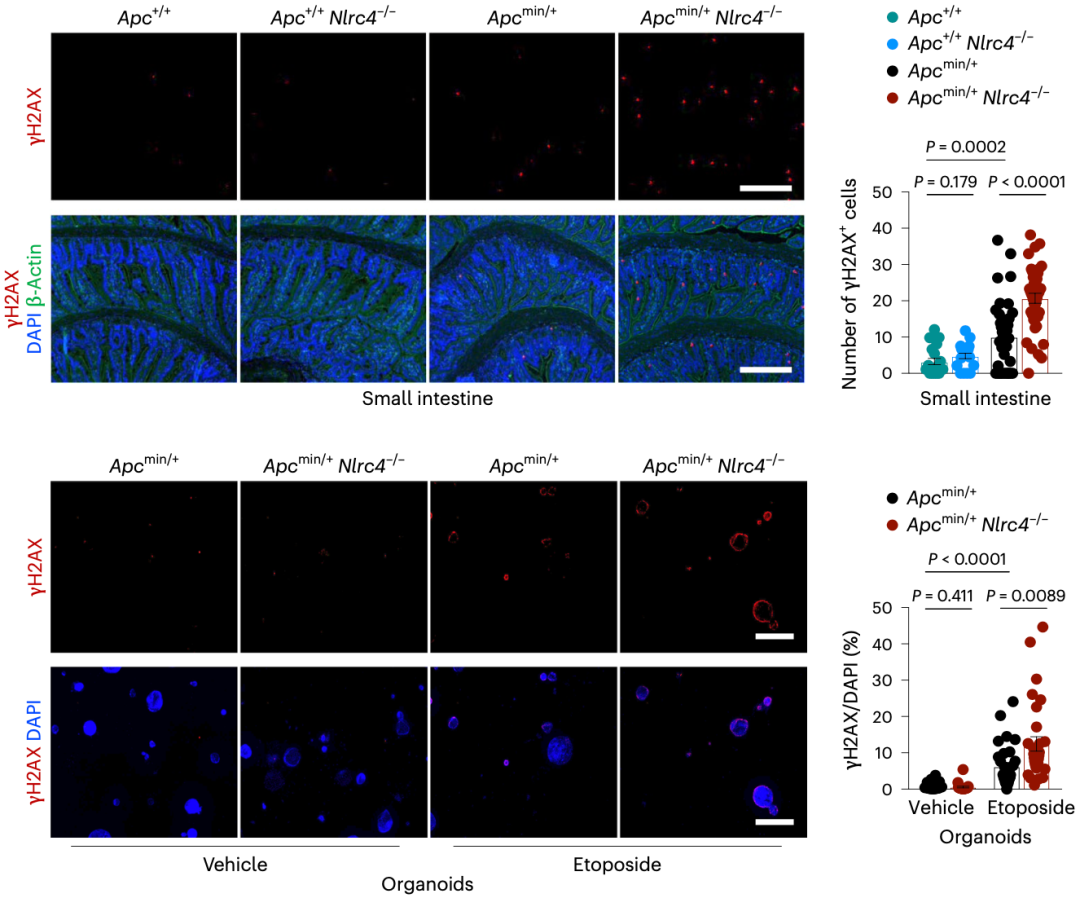
▲NLRC4可减轻细胞中DNA损伤的积累
紧接着,Si Ming Man团队探索了NLRC4减少DNA损伤积累的机制。
他们发现,NLRC4会与ATR相互作用,增强ATR-ATRIP复合物对Caspin的招募,进而激活检查点激酶1(CHK1),促进DNA损伤反应(细胞周期停滞、DNA修复或细胞凋亡[2])。
简单来说,炎症小体NLRC4会通过一种不依赖于促炎功能的机制,促进DNA损伤的修复或促进DNA损伤细胞的凋亡,进而抑制肿瘤的发生或进展。
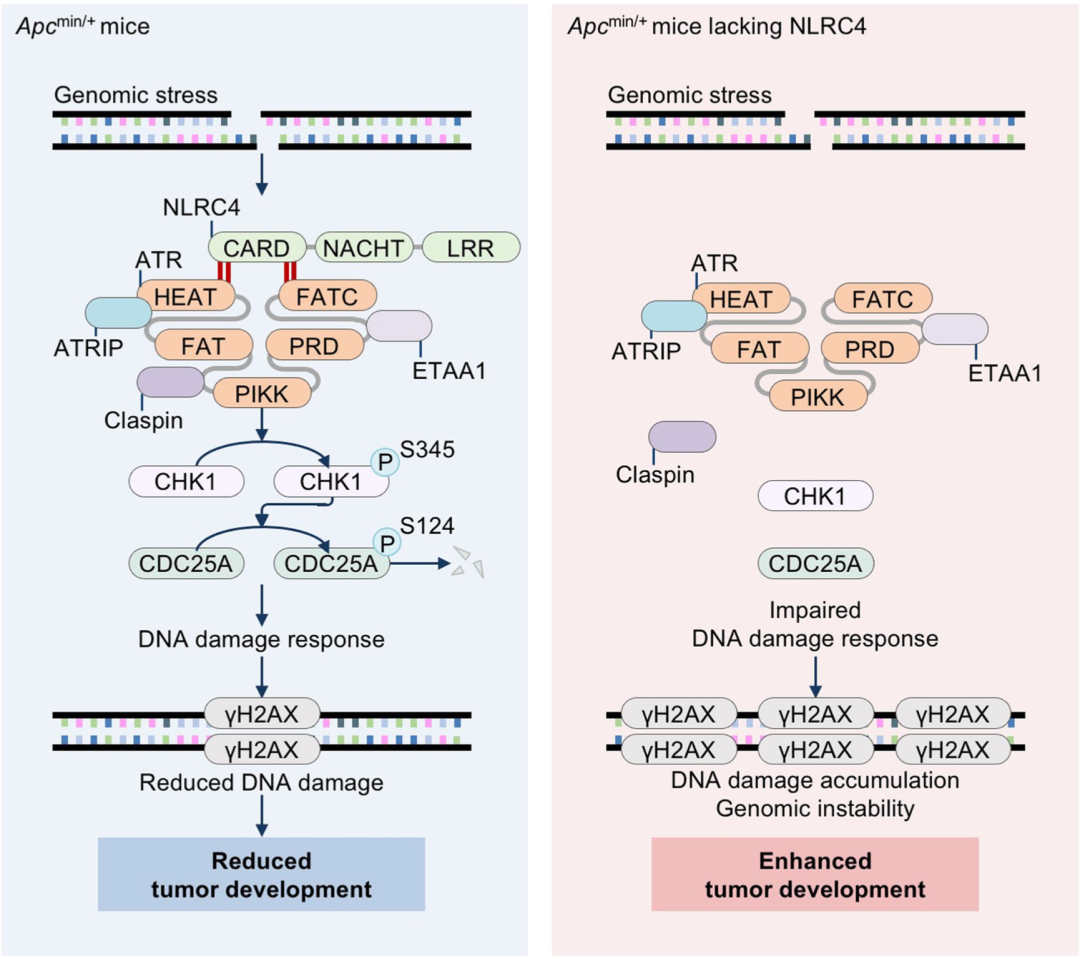
▲机制示意图
总的来说,Si Ming Man团队这项研究成果让我们对先天性免疫、DNA损伤感受/响应和癌症发生发展之间有了新认知。此外,这一发现有望带来新的抗癌靶点,为癌症的防治带来新希望。
参考文献:
[1].Shen C, Pandey A, Enosi Tuipulotu D, et al. Inflammasome protein scaffolds the DNA damage complex during tumor development. Nat Immunol. Published online October 14, 2024. doi:10.1038/s41590-024-01988-6
[2].Patil M, Pabla N, Dong Z. Checkpoint kinase 1 in DNA damage response and cell cycle regulation. Cell Mol Life Sci. 2013;70(21):4009-4021. doi:10.1007/s00018-013-1307-3
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 屡获殊荣:诺华川西南林业碳汇项目荣获《南方周末》2025年度ESG创新案例奖 (2025-07-28)
- 一滴血测早期食管癌!Adv Sci:新型生物芯片结合AI,9种囊泡蛋白助诊断准确率超90% (2025-07-28)
- Science:利用新开发的谱系追踪工具绘制肿瘤细胞的历史和位置,从而揭示其生长模式 (2025-07-28)
- Cell:新研究确定了世界上首个有望预防危及生命的HTLV-1病毒感染的新方法 (2025-07-28)
- 华人学者本周发表6篇Cell论文:逆转阿尔茨海默病、软骨再生、先导编辑疗法、卒中后大脑炎症、人类蛋白质组衰老图谱 (2025-07-28)
- Nature子刊:曾木圣/张华/孙聪团队发现首个EB病毒感染上皮细胞的主要受体 (2025-07-28)
- Cell:新研究表明拉帕司他有望治疗隐孢子虫感染 (2025-07-28)
- Trends Neurosci最新综述:腹侧被盖区(VTA)——压力下的“情绪指挥家” (2025-07-27)
- 不顾作者强烈抗议,Science期刊撤稿了这篇15年前发表的颠覆性论文,“砷基生命”尘埃落定 (2025-07-27)
- Science:一种经过改造的肠道细菌有望对抗肾结石 (2025-07-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















