肠道细菌也能开外挂?Science:新研究揭示拟杆菌如何通过转移遗传因子击败对手 |
 |
来源:100医药网 2024-10-29 13:59
这项研究不仅揭示了肠道细菌如何通过基因转移快速进化,还为我们理解肠道微生物群落的动态提供了新的视角。在我们的肠道里,细菌们就像是一群小战士,通过互相分享基因来快速进化。拟杆菌(Bacteroidales)是一类大量存在的肠道细菌,它们可以交换数百种基因。但这些基因转移对细菌或宿主健康的具体影响,我们还知之甚少。
最近,芝加哥大学的研究人员发现了一种大型、无处不在的移动遗传因子(Mobile Genetic Element, MGE),它改变了常见的人类肠道细菌 脆弱拟杆菌(Bacteroides fragilis)的对抗性武器。
相关研究结果发表在2024年10月25日的Science期刊上,论文标题为 A ubiquitous mobile genetic element changes the antagonistic weaponry of a human gut symbiont 。

拟杆菌的武器库
许多拟杆菌属物种都能通过产生毒素来杀死邻近的细菌。有些毒素会从细菌细胞扩散到周围环境中,消灭附近的敏感菌株。另一种武器是VI型分泌系统(Type VI Secretion System, T6SS),它就像是一个装有弹簧的带毒长矛,直接将毒素注入邻近的细胞。
拟杆菌的T6SS有三种不同的类型,分别是GA1、GA2和GA3。其中,GA3是脆弱拟杆菌特有的,能有效杀死其他拟杆菌属物种。而GA1和GA2则是由一种称为整合性接合元件(Integrative and Conjugative Element, ICE)的大型移动遗传因子编码的。这些ICE在全世界人类肠道中的拟杆菌属物种之间迅速传播。
新武器的出现
芝加哥大学微生物学教授Laurie Comstock博士研究了拟杆菌的不同拮抗机制和它们转移DNA的方式已有十多年。她发现,当脆弱拟杆菌获得了一种较大的移动遗传因子后,它的GA3武器就会失效,但同时又获得了一种新的武器 GA1 T6SS。这种变化帮助细菌在肠道内开辟出新的 壁龛 ,保护提供移动遗传因子DNA的供体菌株。
Comstock说: 这些生物通过DNA转移迅速进化,真是太不可思议了。我们知道某些脆弱拟杆菌菌株无法发射武器,但当我们发现这是由于获得了较大的移动遗传因子时,我们就知道我们发现了一些有趣的东西。
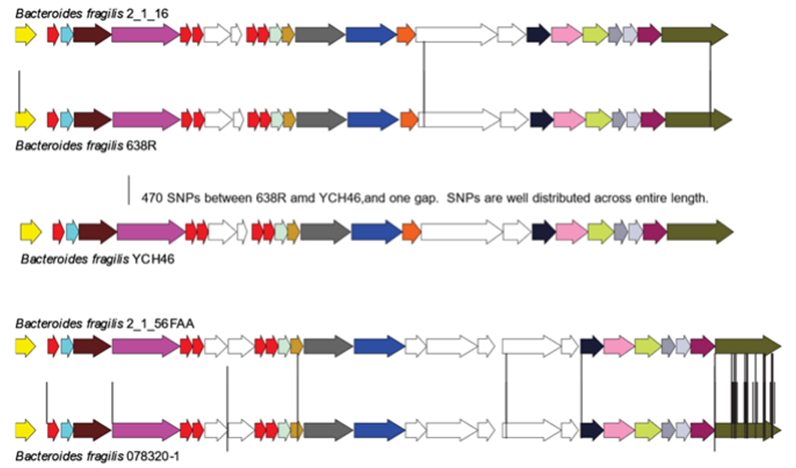
具有相同V1和V2区的脆弱拟杆菌菌株GA3位点的核苷酸差异示意图
实验验证
为了验证这一点,Comstock团队研究了具有GA3 T6SS或同时具有GA3和GA1 ICE的天然脆弱拟杆菌分离株。那些同时具有GA3和GA1 ICE的脆弱拟杆菌分离株不再发射GA3武器,也不再能杀死其他拟杆菌。他们还将GA1 ICE移植到仅具有GA3 T6SS的脆弱拟杆菌菌株中,结果表明,由此产生的新菌株 称为转化接合子(transconjugant),同样无法对抗具有GA3 T6SS的其他菌株。
进一步研究发现,编码GA1纳米机器膜复合体的部分区域阻止了GA3 T6SS的发射。随后,他们在无菌小鼠体内进行了竞争实验,给小鼠口服等量的同源野生型脆弱拟杆菌(仅GA3 T6SS)和GA3/GA1 ICE转化接合子。结果显示,转化接合子很快就在小鼠体内取代了野生型菌株。
转录抑制因子的作用
最令人惊讶的是,在小鼠肠道中,GA3 T6SS根本没有被制造出来。研究人员发现,GA1 ICE上携带的一个基因编码了一种转录抑制因子,它能关闭整个GA3 T6SS的转录,从而更好地产生GA1 T6SS。
这种DNA转移的整体效果对肠道微生物群落产生了影响。含有GA1 ICE的拟杆菌属菌株会被脆弱拟杆菌GA3 T6SS杀死,但如果其中的一种菌株能将其GA1 ICE转移到攻击脆弱拟杆菌的菌株中,由此产生的新菌株不仅不会靶向供体菌株,还能利用GA1 T6SS共同保护所在的生态系统免受其他拟杆菌菌株的入侵。
未来展望
Comstock计划继续研究这个在拟杆菌移动遗传因子上经常携带的多样化转录抑制因子家族及其对受体菌株的影响。她说: 这个转录抑制因子家族在与特定配体结合时会失活。我们很想找出肠道中能解除对它们活性进行抑制的配体。
这项新的研究还表明,在小鼠肠道中,GA1 ICE转移发生得很快,有助于转化接合子成为这个细菌群体中的一个重要组成部分。这提示我们在构建用于治疗的细菌合成联合体时,需要考虑基因转移的影响。Comstock说: 在选择细菌作为生物治疗剂纳入细菌联合体时,必须防止引入任何可能转移到这些菌株或从这些菌株转移出来的、可能产生有害影响的东西。
总之,这项研究不仅揭示了肠道细菌如何通过基因转移快速进化,还为我们理解肠道微生物群落的动态提供了新的视角。随着更多研究的推进,我们有望更深入地了解肠道细菌之间的相互作用,并开发出更有效的治疗方法。(100yiyao.com)
参考资料:
Madeline L. Sheahan et al. . Science, 2024, doi:10.1126/science.adj9504.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 屡获殊荣:诺华川西南林业碳汇项目荣获《南方周末》2025年度ESG创新案例奖 (2025-07-28)
- 一滴血测早期食管癌!Adv Sci:新型生物芯片结合AI,9种囊泡蛋白助诊断准确率超90% (2025-07-28)
- Science:利用新开发的谱系追踪工具绘制肿瘤细胞的历史和位置,从而揭示其生长模式 (2025-07-28)
- Cell:新研究确定了世界上首个有望预防危及生命的HTLV-1病毒感染的新方法 (2025-07-28)
- 华人学者本周发表6篇Cell论文:逆转阿尔茨海默病、软骨再生、先导编辑疗法、卒中后大脑炎症、人类蛋白质组衰老图谱 (2025-07-28)
- Nature子刊:曾木圣/张华/孙聪团队发现首个EB病毒感染上皮细胞的主要受体 (2025-07-28)
- Cell:新研究表明拉帕司他有望治疗隐孢子虫感染 (2025-07-28)
- Trends Neurosci最新综述:腹侧被盖区(VTA)——压力下的“情绪指挥家” (2025-07-27)
- 不顾作者强烈抗议,Science期刊撤稿了这篇15年前发表的颠覆性论文,“砷基生命”尘埃落定 (2025-07-27)
- Science:一种经过改造的肠道细菌有望对抗肾结石 (2025-07-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















