癌细胞也会“偷袭战术”!Nature:癌细胞将自身有缺陷的线粒体DNA转移到T细胞中实现免疫逃避 |
 |
来源:100医药网 2025-02-11 13:38
这项研究揭示了癌细胞如何利用有缺陷的线粒体DNA来削弱免疫细胞的功能,为未来的癌症治疗提供了新的思路。
在一个新的研究中,来自日本千叶癌症中心研究所的研究人员发现了一种令人惊讶的癌症逃避免疫系统的方式。它不仅仅是攻击免疫细胞,而是将自身有缺陷的线粒体DNA(mtDNA, mitochondrial DNA)转移到旨在攻击它的T细胞中。
相关研究结果于2025年1月22日在线发表在Nature期刊上,论文标题为 Immune evasion through mitochondrial transfer in the tumour microenvironment 。

癌细胞的 偷袭战术
这种偷偷摸摸的举动削弱了免疫细胞,使它们在阻止肿瘤方面的效果降低。这些发现可能有助于解释为什么一些癌症治疗,如免疫疗法,对某些患者有效,但对其他患者无效。
在这项研究中,研究人员深入探讨了癌细胞如何与肿瘤浸润淋巴细胞(一种对抗肿瘤的T细胞)相互作用。他们对黑色素瘤和非小细胞肺癌患者的临床样本进行了mtDNA突变分析,并使用线粒体特异性荧光报告物以及多种体外和体内模型来研究线粒体转移现象。此外,他们还评估了肿瘤浸润淋巴细胞的功能、代谢特征及其对免疫检查点抑制剂的反应。
黑色素瘤和肺部样本分析表明,线粒体作为细胞的能量引擎,可以从癌细胞跳到T细胞。这些转移的线粒体在其DNA中携带功能错误,干扰了T细胞的能量产生和功能过程。线粒体对包括T细胞在内的细胞提供能量至关重要,而且T细胞在很大程度上依赖于能量产生来对抗癌症。
但是当癌细胞将有缺陷的线粒体转移到T细胞时,这些有缺陷的线粒体会失去发挥正常功能的能力,从而抑制T细胞的能量,导致它们功能衰竭。研究人员通过两种主要方式观察到了线粒体转移:隧道纳米管(tunneling nanotube) 和 细胞外囊泡(extracellular vesicle)。
隧道纳米管向外延伸并进入T细胞,在细胞之间形成直接输送线粒体的微小通道。细胞外囊泡形为癌细胞释放的气泡,包裹着mtDNA和其他分子。一旦这些受损的线粒体进入T细胞,它们会通过一种通常反向运作的机制取代健康的线粒体。
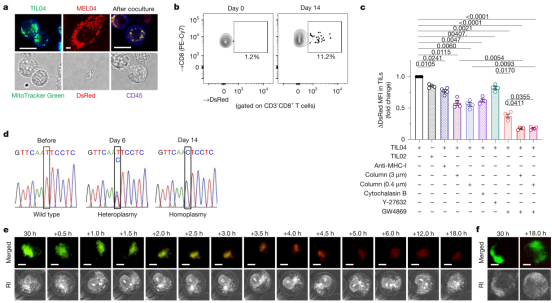
来自癌细胞的发生mtDNA突变的线粒体转移到肿瘤浸润淋巴细胞中
阻止癌细胞的 偷袭
这项研究发现,癌细胞通过附着防止T细胞将受损的线粒体分解的分子来保护转移的线粒体。免疫检查点抑制剂已经彻底改变了癌症的治疗,但并不是每个人都对这些药物反应良好。这项研究表明,肿瘤中线粒体突变较多的患者不太可能从免疫检查点抑制剂中受益,这可能是因为这种受损的线粒体转移已经破坏了他们体内的T细胞。
为了验证这一假设,研究人员使用了一种名为GW4869的化合物,该化合物可以阻止癌细胞释放细胞外囊泡,特别是那些小型的细胞外囊泡样外泌体。在他们的模型中应用这种抑制剂后,从癌细胞到T细胞的线粒体转移显著减少。这种干预不仅帮助防止T细胞摄取受损的线粒体,减少了其功能障碍,还使得T细胞显示出能量产生的改善、衰竭标志物的减少,以及更好地发挥免疫功能的能力。
未来展望
这种阻断策略恢复了免疫检查点抑制剂的有效性,特别是在线粒体转移水平较高的肿瘤中。这些发现表明,靶向细胞外囊泡可能是对抗癌症免疫逃避策略的一种很有前途的方法。
总之,这项研究揭示了癌细胞如何利用有缺陷的线粒体DNA来削弱免疫细胞的功能,为未来的癌症治疗提供了新的思路。通过开发能够阻止这种 偷袭 的治疗方法,科学家们有望提高现有免疫疗法的效果,造福更多患者。( 100yiyao.com)
参考资料:
Hideki Ikedaet al. .Nature, 2025, doi:10.1038/s41586-024-08439-0.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Cell:mRNA疫苗,进军肺结核领域,增加并超越卡介苗保护效果 (2025-09-18)
- Nature子刊:AI从头设计多肽,精准抑制细胞焦亡,开辟炎症疾病治疗新途径 (2025-09-18)
- Nature:胃的“南北战争”!神经组织竟是调控胃功能分区的幕后指挥官 (2025-09-18)
- Nature Medicine:胖,但健康!遗传学如何“解绑”肥胖与心脏病的宿命关联? (2025-09-17)
- 国内唯一获批干细胞药物首位患者出院,国产干细胞药品取得临床应用突破 (2025-09-16)
- 《自然》:慢性压力毁血糖!科学家发现全新调控血糖神经通路,可快速调节肝脏糖生成,反复压力会钝化此通路,导致糖代谢受损 (2025-09-16)
- FDA监管趋严,如何影响中国创新药出海? (2025-09-16)
- JAMA子刊:重大突破!北京安定医院团队首次证实,ANK3可以预测liafensine治疗难治性抑郁症的疗效 (2025-09-16)
- 百奥赛图宣布Tubulis签署抗体许可协议以推进ADC疗法开发 (2025-09-16)
- Science:演化“剧本”的反转!植物,被低估的物种形成“效率大师” (2025-09-16)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















