《肝脏病学》:饿醒巨噬细胞!华科团队首次发现,短期饥饿通过改造巨噬细胞,重振抗肿瘤免疫 |
 |
《肝脏病学》:饿醒巨噬细胞!华科团队首次发现,短期饥饿通过改造巨噬细胞,重振抗肿瘤免疫
来源:奇点糕 2025-03-05 10:35
这个研究揭示了短期饥饿增强抗肿瘤免疫的新机制,为短期饥饿联合免疫检查点抑制剂治疗肝癌提供了新思路。肿瘤相关巨噬细胞,可以说是恶贯满盈了。
远的咱们不说,就说最近这半年,科学家就在顶级期刊上发表了很多巨噬细胞的恶行。
就在上个月,美国杜克大学医学院团队发现,肿瘤相关巨噬细胞可以通过抗原呈递,加速耗竭前体T细胞向终末耗竭T细胞转化[1]。
去年11月中旬,中山大学团队发现,肝癌中的巨噬细胞会将T细胞拦在肿瘤周围,它俩互相活化、共同促癌[2];数天之后,日本大阪大学团队发现,肿瘤中的巨噬细胞会培育免疫抑制能力超强的调节性T细胞,帮助肿瘤实现免疫逃逸[3]。
更过分的是去年8月中旬,荷兰癌症研究所的研究人员发现,胶质母细胞瘤中的巨噬细胞竟会吞噬神经髓鞘,然后生产脂质,喂养癌细胞,满足癌细胞的代谢需求,进而促进癌症的进展[4]。当时我已经找不到合适的词形容肿瘤相关巨噬细胞了,只能送它四个字 首席叛徒 。
那科学家也不能眼看着巨噬细胞为非作歹啊,总得想个办法让它收手,甚至 浪子回头 啊。
近日,由华中科技大学同济医学院附属同济医院张万广、张占国、赵建平和梁慧芳领衔的研究团队,在著名期刊HEPATOLOGY上发表的一篇重要研究论文[5],可能找到了一种让巨噬细胞重回正轨的方法 饿它!
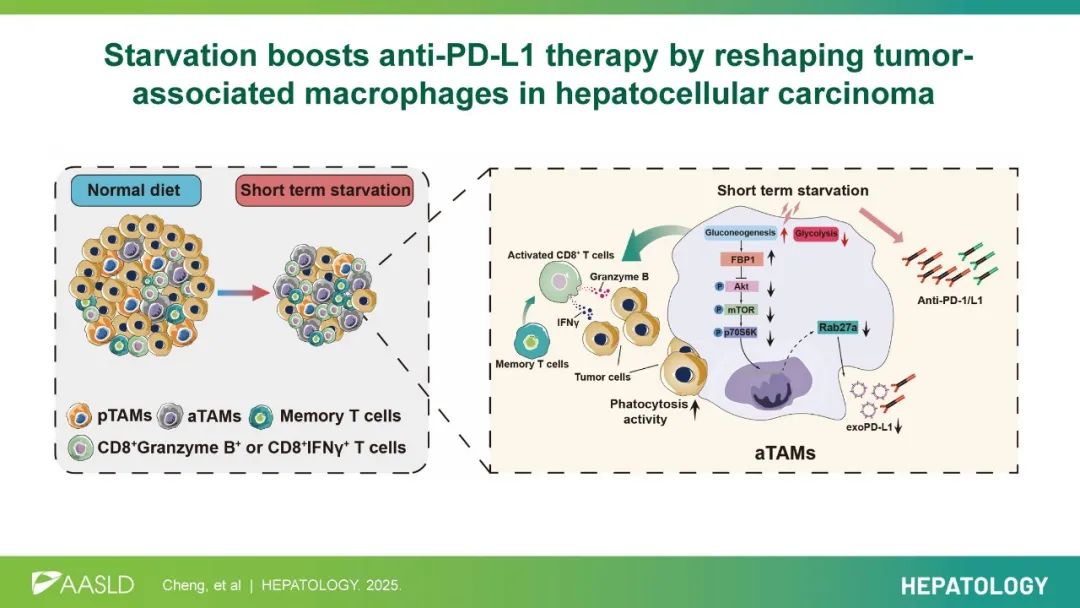
他们基于肝癌小鼠模型首次发现,短期饥饿(STS)可将促癌的巨噬细胞转化成抗癌的巨噬细胞,并提升巨噬细胞的吞噬能力,以及增强CD8阳性T细胞的杀伤能力。值得注意的是,他们还发现,短期饥饿还可以抑制巨噬细胞释放携带PD-L1的外泌体,进而增强PD-L1抑制剂的疗效。
简单来说,这个研究揭示了短期饥饿增强抗的新机制,为短期饥饿联合免疫检查点抑制剂治疗肝癌提供了新思路。程坤、蔡宁和Yang Xing是论文的共同第一作者。

我们都知道,各种各样的热量限制,在基础研究或临床研究中,已经展现出一定的抗肿瘤潜力。
然而,张万广团队注意到,热量限制对消化道肿瘤(尤其是肝癌)的影响,目前还不太明确。于是,他们就在几种肝癌小鼠模型中,测试了两种热量限制饮食(一种类似模拟禁食饮食,另一种就是短期饥饿)对肝癌的影响。
他们就发现,无论是从肿瘤大小和重量来看,还是从小鼠的存活率来看,短期饥饿(STS)的抗肿瘤效果都要好于严格热量限制(SCR)。从研究数据来看,他们也认为,短期饥饿作为一种短期治疗方法,能为肝癌小鼠模型提供安全、稳定和持久的疗效。
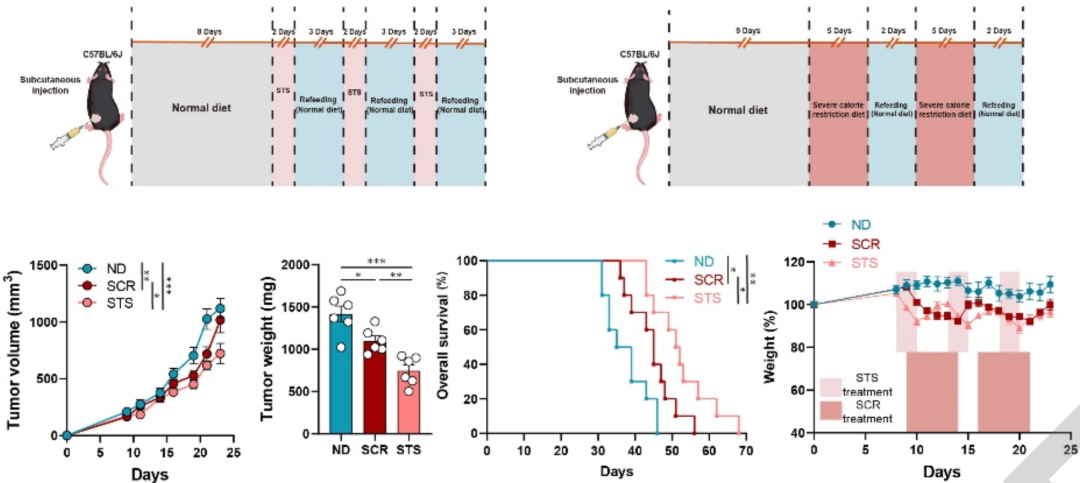
▲短期饥饿(STS)和严格热量限制(SCR)的抗肿瘤效果
接下来就需要探索短期饥饿抗肝癌的潜在机制了。
张万广团队首先发现,在免疫缺陷的小鼠身上,短期饥饿无法发挥抗肿瘤作用,而在免疫正常的小鼠身上可以。显然,短期饥饿抗肝癌需要免疫系统的帮助,或者说是借助于免疫系统。
转录组分析挖出了受影响最大的两种免疫细胞 巨噬细胞和CD8阳性T细胞。首先,短期饥饿竟然把促癌巨噬细胞(pTAMs)转化成了抗癌巨噬细胞(aTAMs)。其次,短期饥饿还让IFN 阳性T细胞和GZMB阳性的CD8阳性T细胞的比例升高,效应记忆T细胞(TEM)的频率也增加了,免疫检查点分子的表达水平也降低了。
很显然,特异性清除特定免疫细胞的实验进一步证实,短期饥饿发挥抗肝癌作用,要依赖于巨噬细胞和CD8阳性T细胞。
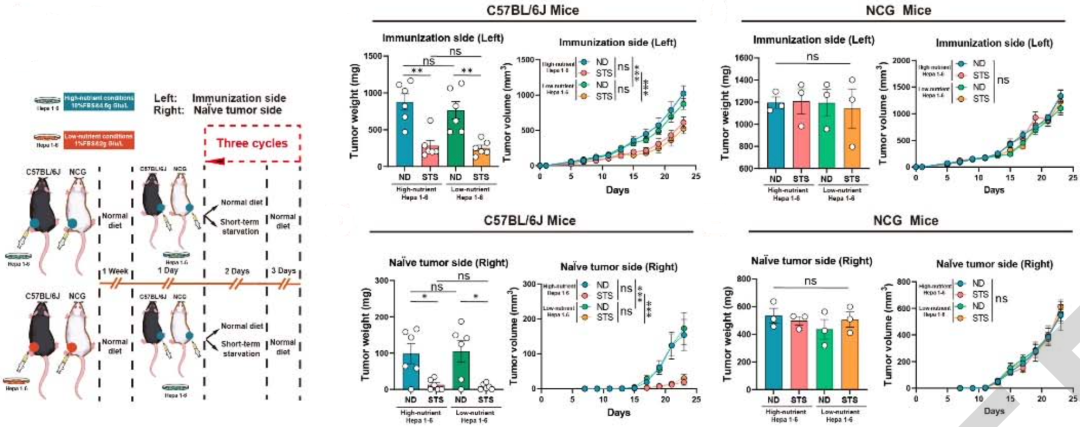
▲短期饥饿抗肝癌需要免疫系统的帮助
后续的机制研究还发现,短期饥饿不仅促进促癌巨噬细胞转化成抗癌巨噬细胞,还增强了抗癌巨噬细胞吞噬能力,以及CD8阳性T细胞抗癌能力的增强,也是巨噬细胞重编程带来的。
也就是说,短期饥饿的抗肝癌能力,主要是通过调节巨噬细胞功能来实现的。
既然短期饥饿改善了肿瘤的微环境,张万广团队很自然就想到了它是否能增强免疫治疗的疗效。于是他们又准备了6组小鼠实验,有对照、短期饥饿处理、PD-1抑制剂治疗、PD-L1抑制剂治疗、短期饥饿+PD-1抑制剂,以及短期饥饿+PD-L1抑制剂。
从肿瘤负担来看,短期饥饿+PD-L1抑制剂抗肿瘤的效果优于短期饥饿+PD-1抑制剂;即使从生存分析结果来看,短期饥饿+PD-L1抑制剂的疗效也是最优的。
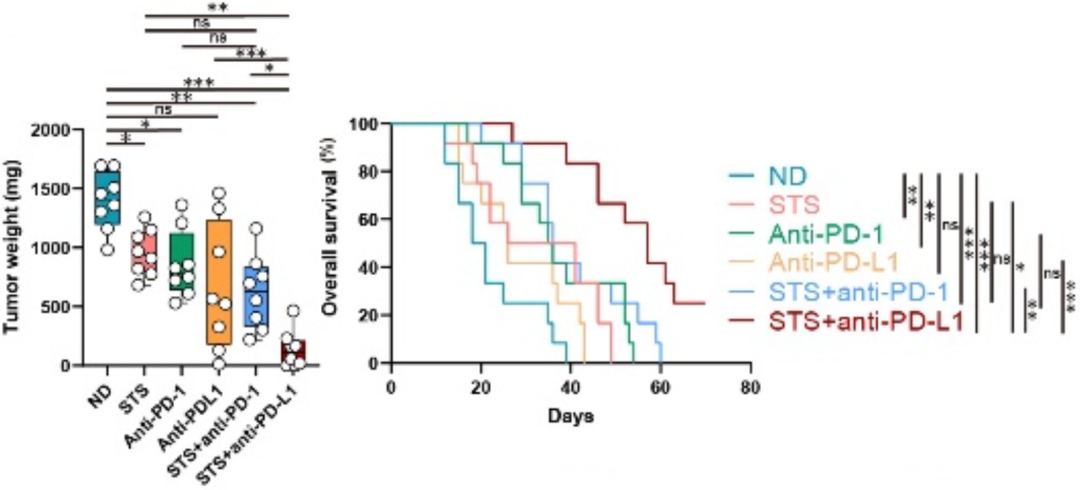
▲短期饥饿+PD-L1抑制剂的疗效最优
看到这个结果,你可能也心存疑问:这短期饥饿咋还区别对待免疫检查点抑制剂呢?
到这里就不得不提癌细胞的一个绝技了。早在2018年,宾夕法尼亚大学的科学家就发现,癌细胞会释放携带PD-L1的外泌体,远程压制全身免疫细胞[6]。
实际上,不仅癌细胞会释放携带PD-L1的外泌体,巨噬细胞也会[7]。因此,张万广团队想知道,通过巨噬细胞发挥抗癌作用的短期饥饿,是不是也影响巨噬细胞释放携带PD-L1的外泌体了。
他们基于肝癌小鼠模型发现,肿瘤相关巨噬细胞确实会释放携带PD-L1的外泌体,而且巨噬细胞外泌体中的PD-L1水平,比癌细胞释放的还高。只要敲除肿瘤相关巨噬细胞的Rab27a基因,就可以抑制外泌体的产生,而且还可以抑制肿瘤生长,增强PD-L1抑制剂的抗肿瘤效果。而敲除的Rab27a基因,则没有增强PD-L1抑制剂抗肿瘤效果的作用。
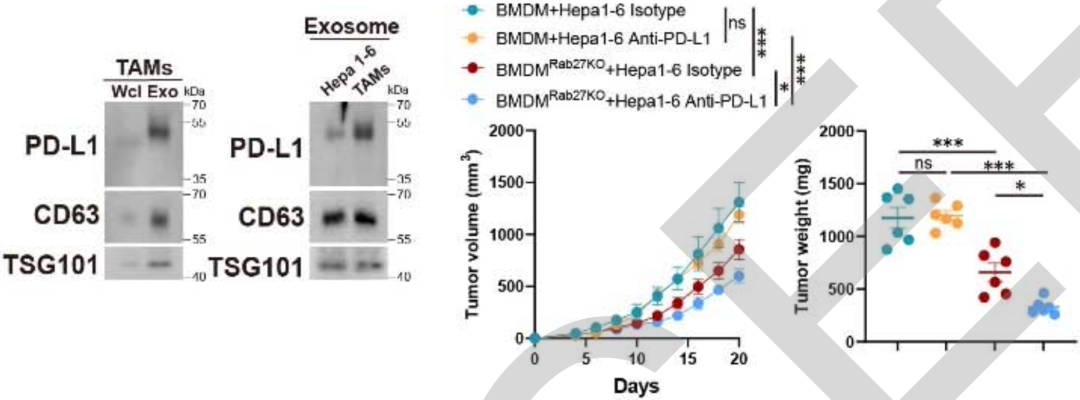
▲巨噬细胞的外泌体确实是影响抗肿瘤免疫的关键
更重要的是,短期饥饿确实抑制了Rab27a的表达,以及抑制了PD-L1外泌体的分泌。
至于背后的分子机制,张万广团队发现,短期饥饿会上调巨噬细胞中果糖二磷酸酶1(FBP1)的水平,FBP1通过与Akt结合,抑制Akt/mTOR磷酸化,进而抑制Rab27a的表达和PD-L1外泌体的产生。
如果短期饥饿能抑制PD-L1外泌体产生的话,那它提升PD-L1抑制剂的效果也就好理解了。此外,值得注意的是,FBP1的表达水平与抗癌巨噬细胞(aTAMs)的比例呈正相关。
▲机制示意图
总的来说,张万广/张占国/赵建平/梁慧芳团队的这项研究成果,让我们对短期饥饿对消化道肿瘤的影响有了新认知。更重要的是,他们揭示了背后的潜在分子机制,也为短期饥饿联合免疫治疗指明了研究方向。
参考文献:
[1].Waibl Polania J, Hoyt-Miggelbrink A, Tomaszewski WH, et al. Antigen presentation by tumor-associated macrophages drives T cells from a progenitor exhaustion state to terminal exhaustion. Immunity. 2025;58(1):232-246.e6. doi:10.1016/j.immuni.2024.11.026
[2].Huang CX, Lao XM, Wang XY, et al. Pericancerous cross-presentation to cytotoxic T lymphocytes impairs immunotherapeutic efficacy in hepatocellular carcinoma. Cancer Cell. 2024;42(12):2082-2097.e10. doi:10.1016/j.ccell.2024.10.012
[3].Kuratani A, Okamoto M, Kishida K, et al. Platelet factor 4-induced TH1-Treg polarization suppresses antitumor immunity. Science. 2024;386(6724):eadn8608. doi:10.1126/science.adn8608
[4].Kloosterman DJ, Erbani J, Boon M, et al. Macrophage-mediated myelin recycling fuels brain cancer malignancy. Cell. 2024;187(19):5336-5356.e30. doi:10.1016/j.cell.2024.07.030
[5].Cheng K, Cai N, Yang X, et al. Short-term starvation boosts anti-PD-L1 therapy by reshaping tumor-associated macrophages in hepatocellular carcinoma. Hepatology. Published online January 29, 2025. doi:10.1097/HEP.0000000000001244
[6].Chen G, Huang AC, Zhang W, et al. Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature. 2018;560(7718):382-386. doi:10.1038/s41586-018-0392-8
[7].Zhong W, Lu Y, Han X, et al. Upregulation of exosome secretion from tumor-associated macrophages plays a key role in the suppression of anti-tumor immunity. Cell Rep. 2023;42(10):113224. doi:10.1016/j.celrep.2023.113224
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 《自然·免疫学》:科学家发现,淋巴结是免疫治疗的引爆点 (2025-10-21)
- Cancer Res:免疫细胞也会“双刀流”?科学家教会抗癌战士新招式,专治耐药肠癌 (2025-10-21)
- 上海德达心血管医院成功举办《胸痛的识别和心脏大血管疾病的规范治疗》研讨会 (2025-10-21)
- 第八届(2025)中国医疗器械创新创业大赛人工智能与医用机器人类别赛圆满落幕 (2025-10-21)
- 上海市下降本市部门医疗服务名目价钱的关照 (2025-10-21)
- 青海省集采药品“三进”种类目次(第一批) (2025-10-21)
- 槲皮素哪个牌子效果好?清肺护肺选什么?长期吸烟该怎么选? (2025-10-21)
- 《自然》:发现燃脂备选方案!科学家首次发现,棕色脂肪中还有一条隐秘的备用燃脂通路,代谢性疾病或迎来治疗新靶点 (2025-10-21)
- Nature子刊:四川大学刘肖珩团队递送miRNA精准调控线粒体代谢,治疗动脉粥样硬化 (2025-10-21)
- Chem Biol Interact新突破:HDAC1抑制剂ZJH-1“精准绞杀”前列腺癌,去势抵抗患者终于等来了新曙光 (2025-10-21)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















