CD:发现推动卵巢癌发生的幕后黑手!科学家发现,高危间充质干细胞,可以诱发卵巢癌发生,对检测和预防具有重要意义 |
 |
CD:发现推动卵巢癌发生的幕后黑手!科学家发现,高危间充质干细胞,可以诱发卵巢癌发生,对检测和预防具有重要意义
来源:奇点糕 2025-04-15 10:27
研究首次明确指出基质微环境在HGSOC起始过程中的关键作用,证实良性基质MSC可在癌前转变为促癌表型,并直接参与上皮细胞恶性转化。高级别浆液性(HGSOC)是最常见的卵巢癌亚型,尚缺乏有效的或早期检测策略。目前的主要预防措施是对携带风险基因BRCA1或BRCA2突变的女性进行双侧输卵管卵巢切除术。
大多数HGSOC肿瘤起源于输卵管上皮(FTE),其直接的前驱病变称为浆液性输卵管上皮内癌(STIC)。关于STIC病变的研究主要集中在上皮细胞的变化,很少探~索STIC病变的微环境。
来自匹兹堡大学的研究团队,在之前的研究中发现,间充质(MSC)能够被重编程,形成与癌症相关的间充质干细胞(CA-MSC),CA-MSCs依赖转录因子WT1表现促癌表型[1]。
近期,研究团队进一步明确了MSCs的功能和促癌作用[2]。
在STIC病变形成之前,已经存在了一个表观遗传改变的间充质干细胞微环境,这些干细胞与CA-MSC具有相似的表观遗传特性和功能,同样高表达WT1,称为高危MSC(hrMSC)。hrMSC在BRCA1/2突变携带者中显著富集,并且随着年龄的增长而增加。
从机制上来说,hrMSC促进FTE细胞的DNA损伤,诱导FTE恶性转化,导致体内转移性癌症。
研究发表在《癌症发现》杂志上。

之前的研究已经发现,CA-MSC几乎存在于所有侵袭性HGSOC病例中,但是尚不清楚CA-MSC的形成时间。研究人员首先探究了癌前病变,即STIC,周围是否存在类似的间质细胞。
研究包括缺陷小鼠+乳腺脂肪垫模型、HGSOC患者以及风险基因携带者输卵管样本,以WT1表达来区分CA-MSC和正常MSC(nMSC),癌前组织中高表达WT1的MSC被命名为高风险MSC(hrMSC,WT1+/CD73+/CD90+/CD105+/CD45-)。研究人员发现,hrMSC在STIC病灶下方和邻近间质区显著富集,丰度接近侵袭性HGSOC中的CA-MSC。hrMSC还存在于没有STIC病变的风险基因携带者输卵管中。
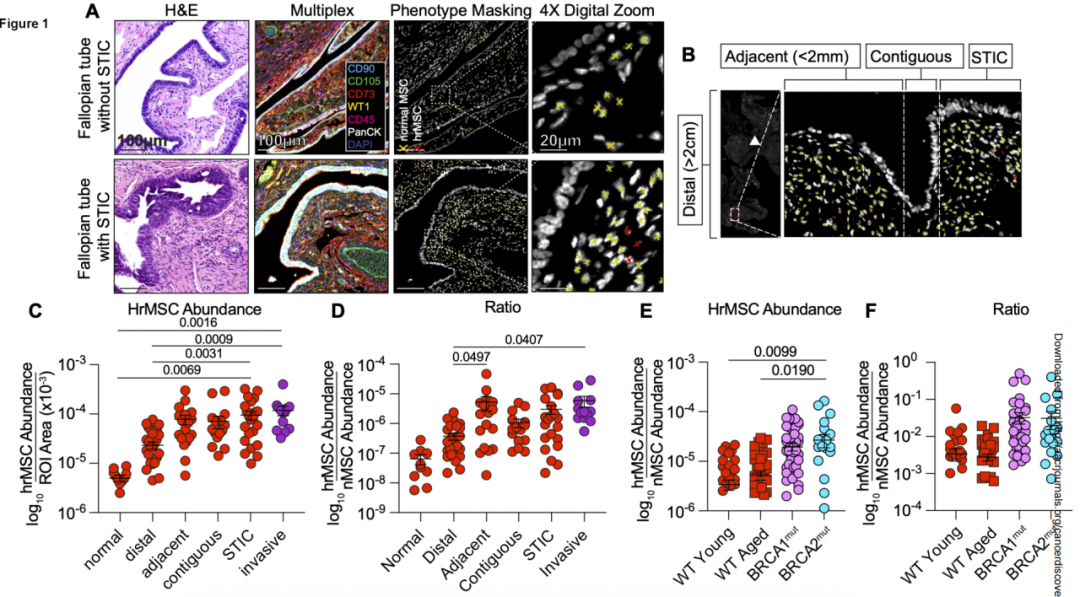
hrMSC在STIC病灶周围富集
数字空间转录组分析显示,STIC病灶下方及周围区域的间质表现出独特的转录特征,形成 间质场效应 ,WT1表达增强贯穿了间质场效应,和上皮之间的WT1表达呈正相关。因此,研究人员推测,STIC周围区域的hrMSC可能是间质场效应的驱动因素,并进一步驱动了HGSOC。
在没有STIC病变的风险基因携带者的输卵管中,MSC已经表现出与CA-MSC相似的表观遗传特性。功能实验中,hrMSC表现与CA-MSC相似,可以促进肿瘤生长。
在细胞实验中,与nMSC相比,hrMSC显著增强癌细胞增殖和球体形成,与癌细胞的结合水平与CA-MSC相当,大约是nMSC的2-3倍。WT1表达介导了hrMSC的肿瘤支持功能。

hrMSC表现出与CA-MSC相似的表观遗传和表型特征
进一步实验证明,hrMSC的肿瘤支持功能对FTE造成影响。共培养条件下,hrMSC显著增加FTE细胞增殖、球形体形成和干性,FTE还表现出更高的DNA损伤,说明hrMSC可能在FTE转化和HGSOC的启动中发挥作用。小鼠体内注射不同类型的FTE细胞与hrMSC共培养,在FTE细胞p53缺失或BRCA1突变条件下,hrMSC在4个月内就会引发肿瘤形成,且有部分肿瘤发生肺和。
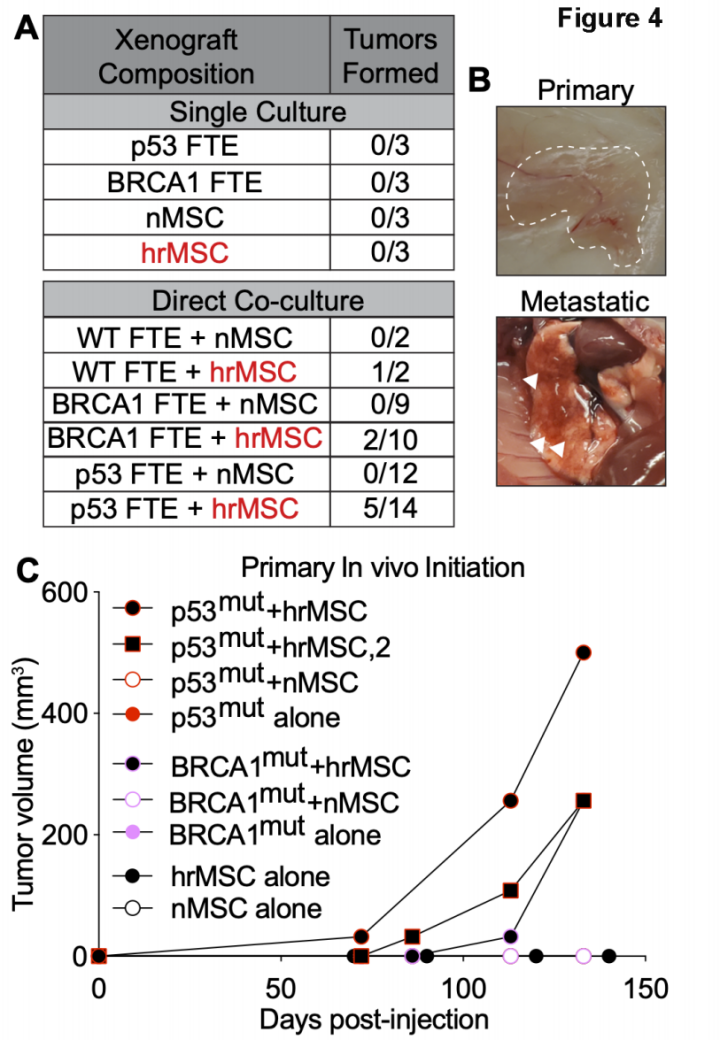
hrMSC诱导FTE细胞恶性转化
hrMSC诱导的恶性转化后的FTE细胞表现出HGSOC突变特征,与DNA损伤、复制压力、氧化应激(ROS)暴露和衰老有关。进一步分析显示,WT1过表达与氧化应激增加相关。作为氧化应激的结果,hrMSC相比于nMSC产生更多的脂质过氧化物,hrMSC通过产生并转运脂质过氧化物分解产物,部分诱导FTE的DNA损伤。
在hrMSC中,AMPK表达下调,从而激活JNK/c-JUN信号通路。JNK/c-JUN通过磷酸化促进c-JUN与WT1启动子的结合,增加WT1的转录和表达。恢复AMPK 1表达,可以减轻hrMSC氧化应激和FTE细胞的DNA损伤。AMPK下调和JNK/c-JUN磷酸化可能是hrMSC促癌特征的关键调控机制。
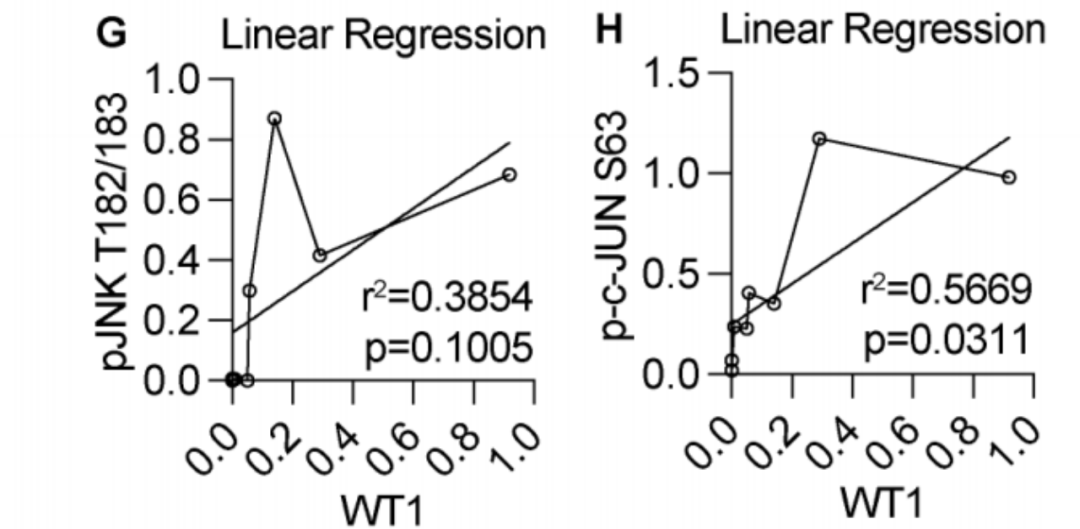
恢复AMPK 1表达降低FTE细胞DNA损伤
总的来说,研究首次明确指出基质微环境在HGSOC起始过程中的关键作用,证实良性基质MSC可在癌前转变为促癌表型,并直接参与上皮细胞恶性转化。这一发现对理解HGSOC形成机制及开发早期检测和预防策略具有重要意义。研究也为探索其他肿瘤发生部位的基质相关机制提供了依据。
参考文献: 1 Fan H, Atiya HI, Wang Y, et al. Epigenomic Reprogramming toward Mesenchymal-Epithelial Transition in Ovarian-Cancer-Associated Mesenchymal Stem Cells Drives Metastasis. Cell Rep. 2020;33(10):108473. doi:10.1016/j.celrep.2020.108472 Garcia GL, Orellana T, Gorecki G, et al. Aged and BRCA mutated stromal cells drive epithelial cell transformation. Cancer Discov. Published online March 14, 2025. doi:10.1158/2159-8290.CD-24-0805
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Science:一种经过改造的肠道细菌有望对抗肾结石 (2025-07-26)
- Science:人类首次实现 用“专属食物”精准遥控肠道内的活体药物 (2025-07-26)
- Science子刊:一种新发现的lncRNA可能解释了2型糖尿病患者肌肉量减少的原因 (2025-07-26)
- 中国药企如何“智闯”沙特? (2025-07-26)
- 马来西亚医疗旅游理事会推出MYMT 2026,打造马来西亚首个医疗旅游年 (2025-07-25)
- Int J Radiat Oncol Biol Phys:MRI导航精准放疗——让高剂量直击肿瘤顽固区,疗效提升还不伤正常组织 (2025-07-25)
- 研究发现乳酸穿梭调控巨噬细胞极化并参与2型糖尿病进程 (2025-07-25)
- 癫痫手术步入毫米时代,仁济多学科联手“机器人+激光”精准消除脑内病灶 (2025-07-25)
- Science:从源头看懂食物过敏——生命早期的一波Thetis细胞浪潮,决定你一生的饮食自由 (2025-07-25)
- Mol Neurodegener:血管“信使”藏玄机,内皮糖蛋白借囊泡激活星形胶质细胞,为阿尔茨海默病治疗指新向 (2025-07-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















