Nature子刊:中山大学松阳洲团队发现DNA损伤修复通路的新选择 |
 |
来源:生物世界 2023-06-19 08:57
该研究揭示了NUMEN作为一个新发现的核膜锚定核酸酶,可以对DSB末端和3" overhang DNA进行切割,产生有利于NHEJ修复的底物,并调控NHEJ/HR通路的选择。NUMEN的核膜定位促进了 DNA双链断裂(DNA double-strand break,DSB)是一种常见且高度有害的DNA损伤形式,严重威胁着基因组稳定性和细胞存活。DSB修复缺陷或失调与肿瘤、衰老以及缺陷等密切相关。非同源末端连接(Non-homolouous end joining,NHEJ)和同源重组(Homologous recombination,HR)是DSB修复的两条主要通路。 一般地,HR被认为是DNA高保真的修复方式,但在特定情况下,如对于富含重复序列的异染色质来说,HR修复则容易造成非等位基因间同源重组(non-allelic homologous recombination,NAHR),从而导致染色体的重排与畸变。因此,细胞如何调控和选择这两种途径对DNA修复的精确性以及基因组稳定性的维持至关重要。 DNA双链断裂末端的加工模式决定了NHEJ/HR修复途径的选择。此外,不同的染色质状态以及核内空间分布也影响着DSB修复,比如异染色质核纤层关联域(Lamina-associated domains,LADs)分布在核周(nuclear periphery),更倾向于原位的NHEJ修复。但是,如何根据不同的染色质状态以及核内空间分布实现不同的DSB末端加工和修复途径的选择,目前研究仍然知之甚少。 PARP抑制剂(PARPi)是临床上治疗BRCA突变和的一线靶向药物,可以通过合成致死的方式特异性杀死BRCA突变的肿瘤细胞。但是,如果肿瘤细胞中NHEJ的某些关键调控因子如53BP1、RIF1等发生缺失或突变,则会导致HR通路重新激活,从而引起对PARPi的抗药性。利用这个特性,可以通过全基因组水平的PARPi耐药筛选,寻找一些能调控NHEJ/HR修复通路选择且未知的NHEJ调控因子。 2023年6月15日,中山大学生命科学学院松阳洲课题组在Nature子刊Nature Cell Biology上发表了题为:Transmembrane nuclease NUMEN/ENDOD1 regulatesDNA repair pathway choice at the nuclear periphery的研究论文。 该研究利用CRISPR筛选,首次报道了核膜锚定的核酸酶NUMEN/ENDOD1参与NHEJ修复通路,并通过特异性切割3"垂悬DNA(3"overhang DNA)调控NHEJ/HR通路的选择。 NUMEN的核膜定位为核周分布的LADs进行NHEJ修复创造了条件,有利于基因组稳定性的维持。另外,NUMEN的缺失也会导致BRCA1突变的肿瘤细胞对PARPi产生耐药。NUMEN的发现解释了细胞如何根据不同染色质状态以及核内空间分布选择最有利的DSB修复方式,以最大程度维持基因组的稳定性。 研究团队首先通过全基因组的CRISPR敲除筛选,得到一系列可造成PARPi耐药的候选基因,其中包括已知的耐药基因如53BP1、RNF168与SLFN11等,证明了筛选结果的可靠性。其中,ENDOD1作为一个潜在的核酸酶,在筛选结果中排名靠前且在DNA损伤修复中的作用几乎未见报道,于是研究人员重点选取了ENDOD1作为实验研究的对象。基于本研究中发现ENDOD1的一些新特征,研究团队将其重新命名为NUMEN(Nuclear membrane endo/exonuclease)。 研究团队接下来验证了NUMEN敲除可导致多种BRCA1突变的肿瘤细胞对PARPi耐药,其缺失也可导致肿瘤细胞对多种DNA损伤药物更为敏感。接下来,研究人员通过体外酶切实验鉴定了NUMEN蛋白的酶活特性,发现NUMEN同时具有核酸内切酶和3" 5"外切酶活性,能特异切割ssDNA以及3"overhang DNA,产生1-4 nt 5"overhang末端。有趣的是,在相同的反应浓度下,NUMEN没有显示出对双链DNA内部和RNA底物有显著的切割活性。NUMEN切割双链DNA末端产生的1-4 nt 5" overhang已被证实比3" overhang DSB具有更高的NHEJ效率,研究人员推测NUMEN参与细胞内NHEJ修复的过程。 进一步,研究团队确认NUMEN敲除可以使细胞核内3" overhang DNA累积增加,HR总体水平升高,NHEJ通路受到破坏;过表达NUMEN则有相反的效果。对于TRF2敲除的细胞,NUMEN失活导致NHEJ依赖的端粒融合比例下降。另外,NUMEN缺失也可以重新激活BRCA1敲除细胞的HR修复通路,这是BRCA1突变细胞产生PARPi耐药的基础。通过以上实验,研究人员证实了NUMEN可以促进NHEJ并抑制HR修复,通过拮抗3"overhang形成参与调控DNA双链损伤修复途径的选择。 免疫荧光结果显示,NUMEN定位于细胞核膜。利用邻近蛋白标记技术(BioID),研究人员进一步鉴定了NUMEN的相互作用蛋白组。除了与NHEJ通路的关键蛋白DNA-PKcs相互作用外,大量的核膜蛋白包括LAD相关蛋白也在质谱中富集。运用超分辨显微镜进行活细胞追踪发现,一部分细胞核内部的DSB损伤点可以动态地移到核膜与NUMEN发生互作;而核周区域产生的DSB也能在核膜附近进行原位修复。 那么,作为一个核酸酶,NUMEN锚定在核膜的意义是什么呢? 结合LADs更倾向于在原位进行NHEJ修复,研究人员猜测NUMEN与LADs的损伤修复相关。为此,研究团队构建了用于追踪LADs的m6A-Tracer系统,发现NUMEN与LADs存在很好的共定位。利用zeocin诱导DSB形成,研究团队发现NHEJ标志蛋白53BP1和RIF1在核周与NUMEN的共定位比HR标志蛋白更多,而NUMEN敲除后53BP1的核周分布则明显减少。利用CRISPR/Cas9对分布在LADs上的LINE重复序列进行切割,研究团队发现NUMEN敲除导致LADs上的DSB修复效率显著变慢。 最后,研究团队通过分析TCGA数据库发现,NUMEN低表达的乳腺癌样本中,与基因组瘢痕(Genomic Scar)相关的几种特征都有所升高;而且NUMEN表达水平与多种肿瘤的基因组拷贝数变异(CNV)呈显著负相关。这提示NUMEN对基因组稳定性的维持起着重要的作用。另外,研究团队还发现,NUMEN与BRCA1的表达水平也有着微妙的平衡关系,研究团队猜测NUMEN可能通过避免高重复序列的异染色质间发生NAHR继而对基因组起保护作用。 综上所述,该研究揭示了NUMEN作为一个新发现的核膜锚定核酸酶,可以对DSB末端和3" overhang DNA进行切割,产生有利于NHEJ修复的底物,并调控NHEJ/HR通路的选择。NUMEN的核膜定位促进了LADs进行NHEJ修复,有助于基因组稳定性的维持。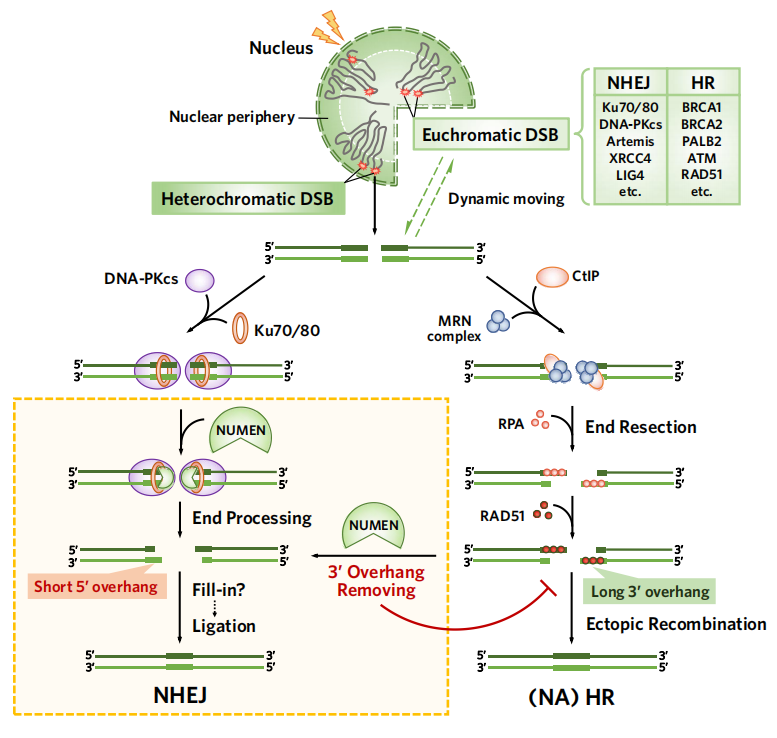

- 相关报道
-
- Nat Biomed Eng:用“声波画笔”调控大脑!新型全息超声技术有望打开人类神经疾病治疗新大门 (2025-10-07)
- 《神经元》:短期高脂饮食也同样危险!科学家发现,两天的高脂饮食即可激活小鼠大脑特定抑制性神经元,导致认知受损,恢复正常饮食可逆转 (2025-10-07)
- 相分离研究登上Nature:超越转录调控,mRNA协调易凝聚蛋白稳态 (2025-10-07)
- 动辄百万美元奖金,这些科学大奖想要与诺贝尔奖竞争:它们含金量如何? (2025-10-06)
- Nature:T细胞耗竭的悖论——并非“精疲力竭”,而是“生产过剩”引发的蛋白毒性风暴 (2025-10-06)
- Cell:沉默的基因组,喧嚣的转录场——解密结核菌适应性的隐藏驱动力 (2025-10-06)
- Nature:谁掌控了人类生命的第一个开关?一个被“驯化”的逆转录病毒的自白 (2025-10-06)
- 三个月,改写生命!全球首例帕金森病实现功能性治愈 (2025-10-05)
- AJP:迄今最长时间真实世界安全性分析显示,艾司氯胺酮鼻喷剂的安全性与临床研究和产品说明书中已确定的一致 (2025-10-05)
- Nature子刊:谭蔚泓/邱丽萍团队开发核酸适配体武装的单核细胞疗法,治疗阿尔茨海默病 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















