Nat Commun:科学家揭示癌症转移到大脑中的新机制 |
 |
来源:100医药网原创 2023-07-05 17:53
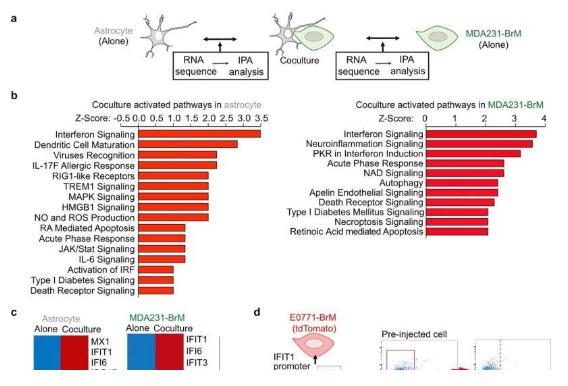
来自Wistar研究所等机构的科学家们通过研究发现,一类名为星形胶质细胞(astrocytes)的脑细胞在通过招募特定的免疫细胞亚群从而在促进癌症大脑转移上发挥着非常重要的角色。当始于机体的癌症开始转移到大脑时,几乎总是致命的,部分原因或许是可选择的疗法较少;近日,一篇发表在国际杂志Nature Communications上题为 Type I interferon response in astrocytes promotes brain metastasis by enhancing monocytic myeloid cell recruitment 的研究报告中,来自Wistar研究所等机构的科学家们通过研究发现,一类名为星形胶质细胞(astrocytes)的脑细胞在通过招募特定的细胞亚群从而在促进癌症大脑转移上发挥着非常重要的角色。
这一研究发现或是科学家们朝着识别抵御转移到大脑中的癌症的新型疗法的潜在靶点迈出的第一步,而且这也将填补科学家们的一个重大的未满足需求,由于针对大脑转移的疗法方法已经非常滞后,即使在其它癌症疗法上已经取得了巨大的进展,这或许就会使得这些癌症的治疗变得更容易一些。这对于癌症患者及其家庭而言或许是毁灭性的,因为患者经历了很多的治疗才从中存活了下来,然而随后癌细胞会扩散到患者的大脑中,这对于患者而言或许是致命性的。
众所周知,多种癌症类型都会转移到大脑中,包括乳腺癌、和黑色素瘤等,其中一个原因就是常规的疗法在抵达大脑后并不能有效发挥作用,大脑是一个与机体其它部位非常不同的器官,其具有独特的脑细胞(神经元和胶质细胞),能为转移的癌细胞提供不同的支持。这项研究中,研究人员想通过研究更好地理解当癌细胞进入到大脑后,诱发癌症转移的癌症-大脑之间的相互作用机制,他们重点关注了星形胶质细胞,其是一种能帮助在神经元之间形成连接的星星样细胞。
利用癌症脑转移小鼠模型进行研究后,研究人员发现,当星形胶质细胞暴露于癌细胞后,其就会开始激活I型干扰素通路,I型干扰素是一种与炎症调节相关的细胞因子,其被证明具有一定的抗肿瘤效应,然而,如今越来越多的研究证据表明,I型IFN信号在慢性炎症和癌症中的作用存在一定的争议。这或许是一项令人兴奋的发现,研究者表示,这也是他们首次揭示I型干扰素反应参与到了促进癌症大脑转移过程中。
科学家揭示癌症转移到大脑中的新机制。
图片来源:Nature Communications (2023). DOI:10.1038/s41467-023-38252-8
研究者发现,干扰素反应会在低水平上被激活,但其持续时间较长,这或许就能解释为何一个通常与帮助免疫系统有关的过程实际上会通过支持肿瘤的生长而对机体造成伤害,此前研究发现,低水平的慢性干扰素反应或会引起负面的健康结局。当研究人员仔细分析时,他们发现,干扰素信号或能激活名为CCL2的趋化因子的产生,这反过来还能吸引称之为单核髓样细胞(monocytic myeloid cells)有害免疫细胞,这些细胞会促进肿瘤的生长。随后研究人员对经过遗传修饰的小鼠进行研究来废除其星形胶质细胞中I性干扰素的激活,结果发现,缺失该通路的小鼠发生脑转移的过程较少。
研究者Chen说道,这或许就表明,星形胶质细胞的I型干扰素反应实际上会促进癌症转移的发生,研究人员在黑色素瘤和乳腺癌细胞中也发现了类似的研究结果,结果表明,这一过程(和潜在的治疗性靶点)或许会在不同的癌症类型中发生;因此研究者希望这一研究发现能鼓励更多研究人员研究导致癌症在大脑中发生转移的相互作用。目前他们迫切需要让更多研究者关注到这一问题,而且也希望未来能有更多的基础研究者和临床医生参与进来,当然也需要更多的资源进行研究。
下一步研究人员正在申请美国国家癌症研究所的资助,旨在进行后续研究来更好地理解星形胶质细胞和干扰素反应如何促进癌症大脑转移背后的机制和时间,从而就能识别出治疗并阻断这一过程的最佳治疗窗口。综上,本文研究中,研究人员阐明了I型IFN在大脑中的促癌转移效应,尽管IFN反应被认为具有一定的抗肿瘤效应;此外,本文研究也有望扩展科学家们对激活癌症的星形胶质细胞和免疫细胞在大脑转移过程中的相互作用的理解。(100yiyao.com)
原始出处:
Ma, W., Oliveira-Nunes, M.C., Xu, K.et al..Nat Commun14, 2632 (2023). doi:10.1038/s41467-023-38252-8
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nat Biomed Eng:用“声波画笔”调控大脑!新型全息超声技术有望打开人类神经疾病治疗新大门 (2025-10-07)
- 《神经元》:短期高脂饮食也同样危险!科学家发现,两天的高脂饮食即可激活小鼠大脑特定抑制性神经元,导致认知受损,恢复正常饮食可逆转 (2025-10-07)
- 相分离研究登上Nature:超越转录调控,mRNA协调易凝聚蛋白稳态 (2025-10-07)
- 动辄百万美元奖金,这些科学大奖想要与诺贝尔奖竞争:它们含金量如何? (2025-10-06)
- Nature:T细胞耗竭的悖论——并非“精疲力竭”,而是“生产过剩”引发的蛋白毒性风暴 (2025-10-06)
- Cell:沉默的基因组,喧嚣的转录场——解密结核菌适应性的隐藏驱动力 (2025-10-06)
- Nature:谁掌控了人类生命的第一个开关?一个被“驯化”的逆转录病毒的自白 (2025-10-06)
- 三个月,改写生命!全球首例帕金森病实现功能性治愈 (2025-10-05)
- AJP:迄今最长时间真实世界安全性分析显示,艾司氯胺酮鼻喷剂的安全性与临床研究和产品说明书中已确定的一致 (2025-10-05)
- Nature子刊:谭蔚泓/邱丽萍团队开发核酸适配体武装的单核细胞疗法,治疗阿尔茨海默病 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















