遗传性血管水肿(HAE)口服疗法!BioCryst血浆激肽释放酶抑制剂berotralstat在美欧日进入审查! |
 |

2020年3月31日讯 /BIOON/ --BioCryst制药公司致力于发现新型、口服、小分子药物,用于治疗酶在疾病生物学通路起关键作用、存在显著未满足医疗需求的罕见疾病。近日,该公司宣布,欧洲药品管理局(EMA)已受理berotralstat(BCX7353,胶囊剂)的营销授权申请(MAA),这是一种每日口服一次的药物,用于预防性血管水肿(HAE)发作。
现在,EMA已开始根据集中程序(CP)对MAA进行正式审查。EMA人用医药产品委员会(CHMP)预计将在12个月内给出审查意见。如果获得批准,berotralstat胶囊剂将成为欧洲首个被批准用于HAE预防的靶向口服疗法,将为HAE患者的治疗带来重大进展。
BioCryst公司预计,在2020年至2021年初,berotralstat将获得三项监管批准。今年2月,美国食品和药物管理局()受理了berotralstat的新药申请(NDA),并已指定处方药用户收费法(PDUFA)目标日期为2020年12月3日。此外,日本药品和管理局(PMDA)也正在根据Sakigake时间表对berotralstat的新药申请(JNDA)进行审查,预计2020年下半年批准。
berotralstat化学结构(图片来源:probechem.cn)
berotralstat是一种新型、口服、每日一次、强效、选择性人血浆激肽释放酶抑制剂,目前处于后期临床开发,用于预防和治疗性血管水肿(HAE)患者的血管水肿发作。
目前,BioCryst公司正在开发berotralstat的2种制剂,胶囊剂开发用于预防HAE发作,口服液体制剂目前处于II期临床开发,用于治疗急性HAE发作。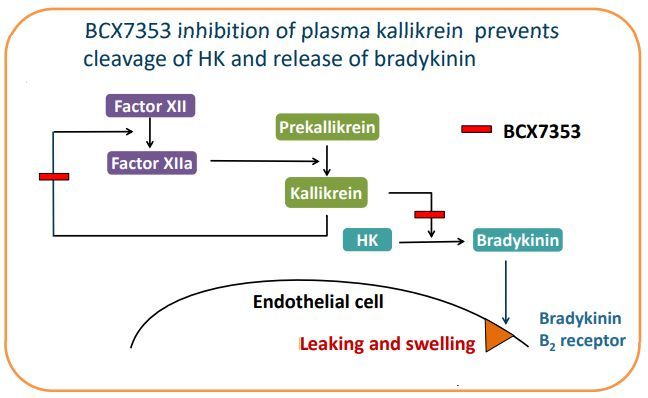
berotralstat作用机制
在III期APeX-2和II期APeX-1临床试验中,berotralstat表现出良好的安全性和耐受性。在III期APxE-2中,与安慰剂相比,berotralstat(150mg)将HAE发作率显著降低了44%(p<0.001)、并且在50%的患者中将HAE发作率降低≥70%。
本月中旬,BioCryst公司公布了APxE-2的新数据:与安慰剂相比,berotralstat(150mg)将每月需要使用标准护理(SoC)按需治疗的HAE发作次数降低了53.6%、将需要急性SoC治疗的HAE发作次数降低了49.2%(p<0.001)。额外的新数据显示,接受berotralstat(150mg)治疗的患者,需要再次接受多剂量按需治疗的HAE发作的百分比低于安慰剂组。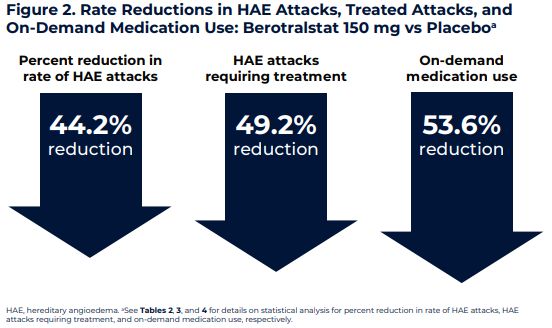
与安慰剂相比,接受berotralstat治疗的患者发作次数更少、治疗更少、经历更少的严重发作、使用更少的按需治疗。这些数据进一步证明,HAE患者每天口服一次berotralstat可获得显著的治疗受益。
目前,BioCryst公司正在开展APeX-S,这是一项长期安全性临床试验。此外,BioCryst公司也完成了ZENITH-1临床试验,这是一项概念验证II期,评估了berotralstat口服液体制剂治疗急性血管水肿发作。(100医药网100yiyao.com)
原文出处:European Medicines Agency Validates Marketing Authorization lication for Oral, Once-Daily Berotralstat (BCX7353) to Prevent HAE Attacks
医药网新闻
- 相关报道
-
- Nature Methods:蛋白质“变形金刚”设计指南——AI“脑补”自然进化,一键生成智能分子开关 (2025-08-10)
- N Engl J Med:改写移植规则!从“免疫耐受”迈向“免疫规避”的新纪元 (2025-08-10)
- Science重磅:破解阿尔茨海默病抗体药的脑出血副作用——突破血脑屏障,靶向递送抗Aβ抗体 (2025-08-10)
- Nat Rev Neurosci重要综述:自主神经系统的分子和功能多样性——系统回顾了该领域近十年来的关键进展 (2025-08-09)
- Cancer Cell:于君团队证实,补充这种益生菌,可增强结直肠癌免疫治疗效果 (2025-08-09)
- Cancer Cell:魏嘉/李颜团队揭示未成熟中性粒细胞在癌症骨转移中的关键作用,并提出治疗新策略 (2025-08-09)
- 为何CAR-T 疗法易复发?Mol Cancer:细胞衰老成“隐形杀手”,共刺激域差异决定疗效命运 (2025-08-08)
- Nature:多发性硬化症的“元凶”现身?科学家揭示EB病毒惊人发现! (2025-08-08)
- Nature:锂缺乏或会诱发阿尔兹海默病,但锂化合物却能逆转小鼠疾病 (2025-08-08)
- 不止供能,还能抗癌?!Cell Metabol:葡萄糖能帮抗癌 T 细胞“充电”!糖鞘脂合成是关键 (2025-08-08)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















