国产抗PD |
 |

2020年05月10日讯 /BIOON/ --君实生物近日宣布,国家药品监督管理局(NMPA)已受理抗PD-1抗体药物特瑞普利单抗(商品名:拓益)用于治疗既往接受过治疗的局部进展或转移性尿路上皮癌(UC)患者的新适应症上市申请。
尿路上皮癌(UC)是全球范围内最常见的泌尿系统癌症。早期以手术治疗为主,对于不能手术的局部进展或转移性尿路上皮癌患者,以铂类为基础的化疗是其标准的一线治疗,随着化疗敏感性下降,会导致复发和疾病进展。对于此类标准治疗后出现疾病进展的晚期尿路上皮癌患者,目前国内治疗手段非常有限。
值得一提的是,今年4月,百济神州抗PD-1抗体药物百泽安 (通用名:替雷利珠单抗注射液)获得NMPA批准,用于治疗接受含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性PD-L1高表达的UC患者。2019年12月底,百泽安 获NMPA批准,用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤(R/R cHL)患者。
在全球范围内,目前已有11款PD-(L)1疗法获得批准,其中已有8款在中国获批。这11款疗法中,已有6款获批尿路上皮癌(UC)适应症。值得一提的是,百泽安 是国内首个被批准治疗UC的抗PD-(L)1疗法。(点击图片查看大图)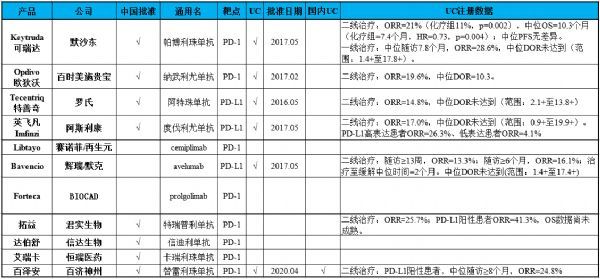
君实生物的抗PD-1抗体药物特瑞普利单抗(商品名:拓益)于2018年12月获得NMPA批准上市销售,成为中国首个自主研发的PD-1单抗,该药适应症为:用于既往接受全身系统治疗失败的不可切除或转移性的治疗。特瑞普利单抗注射液的获批,填补了国产PD-1单抗的空白,更多中国患者将有机会获得国际先进水平的免疫治疗。
今年4月底,NMPA受理特瑞普利单抗(商品名:拓益)用于治疗既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌(NPC)患者的新适应症上市申请。这也是全球首个抗PD-1单抗治疗复发/转移性鼻咽癌的新药上市申请。
此次UC新适应症的上市申请,基于POLARIS-03研究(NCT03113266),为一项开放性、单臂、多中心、Ⅱ期关键注册临床研究,旨在评估特瑞普利单抗治疗标准治疗失败后的局部进展或转移性膀胱尿路上皮癌患者的安全性和有效性,由北京大学医院郭军教授与上海交通大学医学院附属仁济医院黄翼然教授共同牵头。
在今年2月举办的美国临床肿瘤学会泌尿生殖系统研讨会(ASCO GU)上,POLARIS-03研究公布了临床入组结束后的分析数据,研究共入组151例局部晚期或转移性尿路上皮癌患者。至数据截止日,独立评估结果显示,在符合评估条件的148例患者中,总体客观缓解率(ORR)为25.7%,PD-L1阳性患者(46例,31.1%)ORR达到41.3%,OS数据尚未成熟,安全性数据与特瑞普利单抗过往报道基本一致。本研究的更新数据将在近期国际学术大会ASCO年会上公布。
君实生物首席执行官李宁博士表示:“继上周取得鼻咽癌适应症的上市受理后,特瑞普利单抗达成又一里程碑,标志着我们针对、鼻咽癌、尿路上皮癌等‘细分领域’适应症的布局已进入新的阶段。对于二线治疗晚期泌尿系统,免疫疗法已在全球范围内显示出了一定优势。POLARIS-03研究是一项针对晚期尿路上皮癌总体人群的II期临床研究。今年国际大会上发表的研究结果显示,无论患者的PD-L1表达状态如何,二线接受特瑞普利单抗治疗均有获益,其表现不亚于任何PD-1/PD-L1二线治疗晚期尿路上皮癌研究。我们正与监管部门积极合作,希望尽早为晚期尿路上皮癌患者提供更多治疗选择。”(100医药网100yiyao.com)
原文出处:君实生物、100医药网
医药网新闻
- 相关报道
-
- J Gen Physiol:蛋白cMyBP-C对维持心脏健康至关重要 (2025-07-24)
- 孔雀开屏:首都医科大学最新论文登上Cell子刊封面 (2025-07-24)
- CSC:促癌异常竟成阿尔茨海默病保护伞?贝勒医学院团队发现,TET2突变型髓系细胞会进入大脑和增强吞噬作用,抑制阿尔茨海默病发展 (2025-07-24)
- Nature:从肿瘤坏死到转移,中性粒细胞竟藏着如此惊人“秘密” (2025-07-24)
- 华人学者最新Cell论文:老药新用显奇效,逆转阿尔茨海默病,恢复记忆力 (2025-07-24)
- Nature头条:新冠大流期间,人类大脑衰老加快,即便未感染的人也是如此 (2025-07-23)
- 骨髓“小工厂”新突破!Stem Cell Res Ther:基因改造基质细胞巧建仿生微环境,无需额外养料也能养好造血干细胞 (2025-07-23)
- 直播预告 | 单细胞×时空组学:疾病免疫研究的前沿实践与应用 (2025-07-23)
- Cell:我国科学家绘制出猕猴前额叶皮层神经元全脑投射组,从而揭示灵长类动物特异性的连接原理 (2025-07-23)
- 细胞外囊泡检测新突破!Anal Chem:免疫磁珠结合mRNA定量技术灵敏度远超传统方法,为疾病诊断添利器 (2025-07-22)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040
|
| ||
 |
 |
| 解决便秘的偏方 | 女孩向往 |
 |
 |
| 婴儿出生时瞬间 | 西红柿养生功效 |


















