研究揭示血清素5 |
 |
《美国国家科学院刊》(PNAS)在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)汪胜研究组和丛尧研究组完成的研究成果(Structural insights into constitutive activity of 5-HT6 receptor)。该研究通过解析血清素受体5-HT6-Gs复合物的结构,揭示了5-HT6受体不依赖于配体的高水平组成性活性的决定性因素,阐明了5-HT6受体高组成性活性的分子机制,并以结构为导向设计了受体特异性纳米抗体NB6A1,为剖析G蛋白偶联受体(GPCR)组成性活性的理论机制提供了重要信息。
血清素是重要的神经递质,在调节情感、认知、学习、记忆、疼痛等一系列生理活动中起着重要作用。血清素通过作用于血清素受体发挥功能。人体内的血清素受体一般7个家族(5-HT1-7)13种亚型,除了5-HT3是配体门控离子通道外,其余均是具有7次跨膜螺旋结构的GPCR。与多数血清素受体不同,5-HT6受体仅分布在中枢神经系统中,靶向该受体已被证明在治疗阿尔兹海默症、精神分裂症等神经精神疾病具有重要作用。此外,5-HT6受体表现出的不依赖于配体的高水平组成性活性,与神经元发育、新皮层径向迁移和人神经的自我更新有关。众所周知,多数受体均具有不同程度的不依赖于其配体的组成性活性,而这种组成性活性的确切机制仍未知。
本研究利用冷冻电镜技术,成功解析了血清素激活5-HT6受体与Gs蛋白形成复合物的高分辨率冷冻电镜结构。基于结构的解析,通过体外功能性实验,研究揭示了5-HT6受体不依赖于配体高组成性活性的结构决定因素,即钠离子结合口袋的破坏和G蛋白 亚基与受体的高效解离。
研究组的前期工作(Science,2017)和同期的系列研究表明,GPCR普遍存在钠离子结合位点,且该结合位点在整个A类GPCR中高度保守。钠离子与GPCR的结合一直以来被认为是维持受体处于非激活状态的关键因子。而该工作中的高分辨率冷冻电镜结构表明,5-HT6受体第280位的苏氨酸和第312位的天冬氨酸之间形成的氢键破坏了钠离子结合口袋,影响了5-HT6受体与钠离子的结合,使得受体更易于处于激活状态;GPCR激活后,G蛋白 亚基和 亚基分离,并进一步与受体解离,完成整个受体的激活过程。5-HT6受体第325位的精氨酸和G蛋白 亚基第378位的精氨酸之间产生的同电荷互斥作用,使得G蛋白 亚基能够快速从受体中解离,进而高效完成受体介导的下游信号激活过程。上述两方面因素的协同作用维持了5-HT6受体的高组成性活性。基于以上结构特征,汪胜研究组设计并筛选出5-HT6受体特异性结合的纳米抗体-NB6A1,通过体外功能实验验证了其能显著降低受体组成性活性,进一步确认了5-HT6受体组成性活性的结构基础,为后续探究GPCR组成性活性的理论机制提供了重要信息。
研究工作得到科技部、国家、中科院和上海市科学技术委员会等的资助,并获得国家蛋白质科学研究(上海)设施冷冻电镜系统、数据库与计算分析系统的支持。
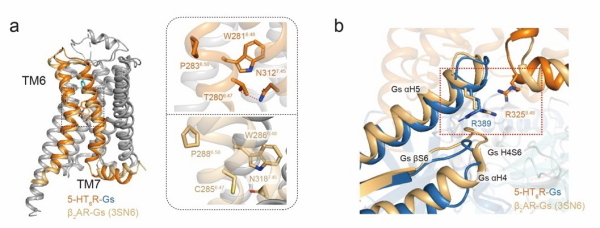
5-HT6受体高组成性活性的结构决定因素
医药网新闻
- 相关报道
-
- 赛诺菲胰岛素原料药项目启动,助力北京打造全球医药健康产业高地 (2025-10-18)
- Nature Medicine:首次人体实验,PD-1单抗治疗艾滋病 (2025-10-18)
- 百年药企参天公司旗下维生素B12滴眼液参天玫瑰®焕新上市 (2025-10-17)
- 神经元只负责“干活”?Nature:星形胶质细胞才是记忆“保存总监”,双重认证锁死重要记忆 (2025-10-17)
- 赛诺菲胰岛素原料药项目启动,助力北京打造全球医药健康产业高地 (2025-10-17)
- Nat Cell Biol:结肠癌也“分地段”?科学家找到决定癌症位置的“源头细胞” (2025-10-17)
- 干细胞变“唾液腺修复贴片”!Stem Cell Reports证实:人诱导多能干细胞来源细胞片可与损伤腺体整合,为口干症治疗开辟新路径 (2025-10-17)
- 律动不息 上海德达心血管医院开展2025世界心脏日系列护心活动 (2025-10-17)
- 科研人员开放染色质互作新技术并鉴定人类胎脑的独特基因空间调控模式 (2025-10-17)
- 《癌症研究》:空军军医大学团队发现,肠癌细胞释放外泌体重编程成纤维细胞,驱动结直肠癌转移 (2025-10-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















