PNAS:科学家有望开发出一种能改善实体瘤中T细胞疗法效力的潜在策略 |
 |
来源:100医药网原创 2023-04-11 11:35
来自宾夕法尼亚大学等机构的科学家们通过进行临床前研究开发出了一种新方法,其或能“连环攻击”来帮助T细胞攻击实体瘤。针对实体瘤的T细胞疗法的一个基本限制就是失去炎性效应功能,比如细胞因子的产生和增殖等。近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为 Combined disruption of T cell inflammatory regulators Regnase-1 and Roquin-1 enhances antitumor activity of engineered human T cells 的研究报告中,来自宾夕法尼亚大学等机构的科学家们通过进行临床前研究开发出了一种新方法,其或能 连环攻击 来帮助T细胞攻击实体瘤,研究者指出,靶向作用两个能控制与炎症相关的基因功能的调节子或许能使得模型中的T细胞扩增至少提高10倍,从而就会提高机体的抗肿瘤活性和持久性。
细胞疗法是Carl H. June博士所开创的,其带领研究团队于2017年首次开发并获批了用于治疗B细胞急性淋巴细胞的CAR-T细胞疗法,从那时开始,个体化的细胞疗法就给血液癌症的治疗带来了革命性的变革,但对于诸如和等实体瘤而言却似乎并没有有效的疗法。June说道,我们希望能为实体瘤患者解锁新型的CAR-T细胞疗法,其中就包括最常被的癌症类型,而本文研究结果表明,免疫炎性调节子的靶向作用或许就值得进一步研究来增强T细胞的效力。
治疗实体瘤的CAR-T细胞疗法的挑战之一就是一种被称之为T细胞耗竭(T cell exhaustion)的现象,即来自实体瘤细胞群的持续性抗原暴露会使得T细胞变得疲惫不堪,以至于其无法在机体中发起抗肿瘤反应,而对来自患者机体已经耗竭的T细胞进行工程化改造而进行的CAR-T细胞疗法则会导致 产品 的有效性降低,因为T细胞并没有足够的繁殖能力,也并未很好地记住其任务。
此前的观察性研究结果表明,炎性调节子Regnase-1或许能作为潜在的靶点来间接克服T细胞耗竭所产生的影响效应,因为其能在T细胞被破坏时引起过度炎性反应,使其恢复活力则能产生一定的抗肿瘤反应;研究者推测,同时靶向作用相关但又独立的Roquin-1调节子或能进一步增强机体的免疫反应。研究者Mai说道,这两个调节性基因中的每一个都会参与限制T细胞的炎性反应,但我们发现,同时破坏其二者的功能或许就会比单独破坏其二者中任何一个产生更大的抗癌效应,但基于此前研究结果,研究人员距离开发在实体瘤背景下更有希望的策略或许又近了一步。
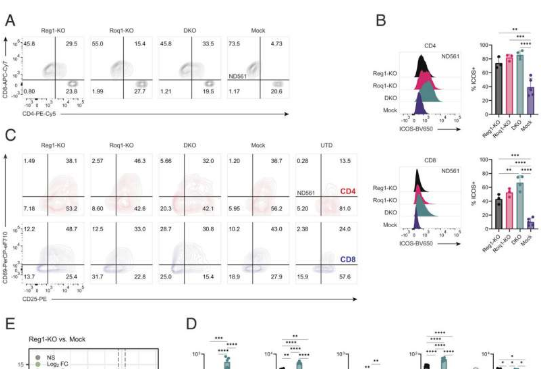
科学家有望开发出一种能改善实体瘤中T细胞疗法效力的潜在策略。
图片来源:Proceedings of the National Academy of Sciences (2023). DOI:10.1073/pnas.2218632120
随后研究人员利用CRISPR-Cas9基因编辑技术单独或共同敲出了健康供体T细胞中的Regnase-1和Roquin-1基因,目前研究人员正在一项I期临床试验中对两种不同的免疫受体进行研究,即靶向作用间皮素的M5 CAR (mesoCAR)和靶向作用NY-ESO-1的8F TCR (NYESO TCR),这两种工程化的T细胞产品都不会靶向作用CD19,CD19是大多数获批的CAR-T细胞疗法所针对的抗原,因为这种抗原并不存在于实体瘤中。当进行CRISPR编辑后,T细胞会被扩张并输注到实体瘤小鼠模型中,研究者观察到,相比单独失活Regnase-1而言,双重敲除会使得所产生的工程化T细胞的数量是前者的10倍,且还能增加机体的抗活性及工程化T细胞的寿命,在一些小鼠中则会导致淋巴细胞的过度产生,从而引起毒性反应。
研究者Sheppard表示,CRISPR是一种能完全消融诸如Regnase和Roquin靶向基因表达的游泳工具,从而就会产生一种明确的表型,然而在将这项研究工作转移到临床环境中时,或许还有其它策略需要考虑,比如条件基因调控的形式等。当然,研究人员对于敲除这两个非冗余蛋白从而释放出的抗肿瘤潜力印象深刻,在实体瘤研究中,研究人员观察到了CAR-T细胞的扩张有限,但如果能够让每个T细胞都变得更加有效力或许就能复制产生更大数量的细胞,而这或许就给予攻击实体瘤提供了更好的机会。
综上,本文研究结果表明,免疫炎性功能的调节子或许是非常有趣的靶点,其能调节帮助改善机体的抗肿瘤免疫反应。(100yiyao.com)
原始出处:
David Mai, Omar Johnson, Jordan Reff, et al. , Proceedings of the National Academy of Sciences (2023). DOI:10.1073/pnas.2218632120
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 明眸皓齿打一个正确的生肖,最佳资询落实 (2025-09-13)
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















