最新研究成果 |
 |
来源:清华大学药学院 2023-04-28 11:21
2023年4月6日,尹航研究组在外泌体领域旗舰期刊Journal of Extracellular Vesicles上发表题为“Exosomal lipid PI4P regulates2023年4月6日,尹航研究组在外泌体领域旗舰期刊Journal of Extracellular Vesicles上发表题为 Exosomal lipid PI4P regulates small extracellular vesicle secretion by modulating intraluminal vesicle formation 的文章,报道了一项新的PI4P在调控EV生成的分子机制,并且为EVs调控天然TLR4信号调控提供新证据,为新的EV调控与TLR4天然免疫信号调控提供潜在靶点(图1)。
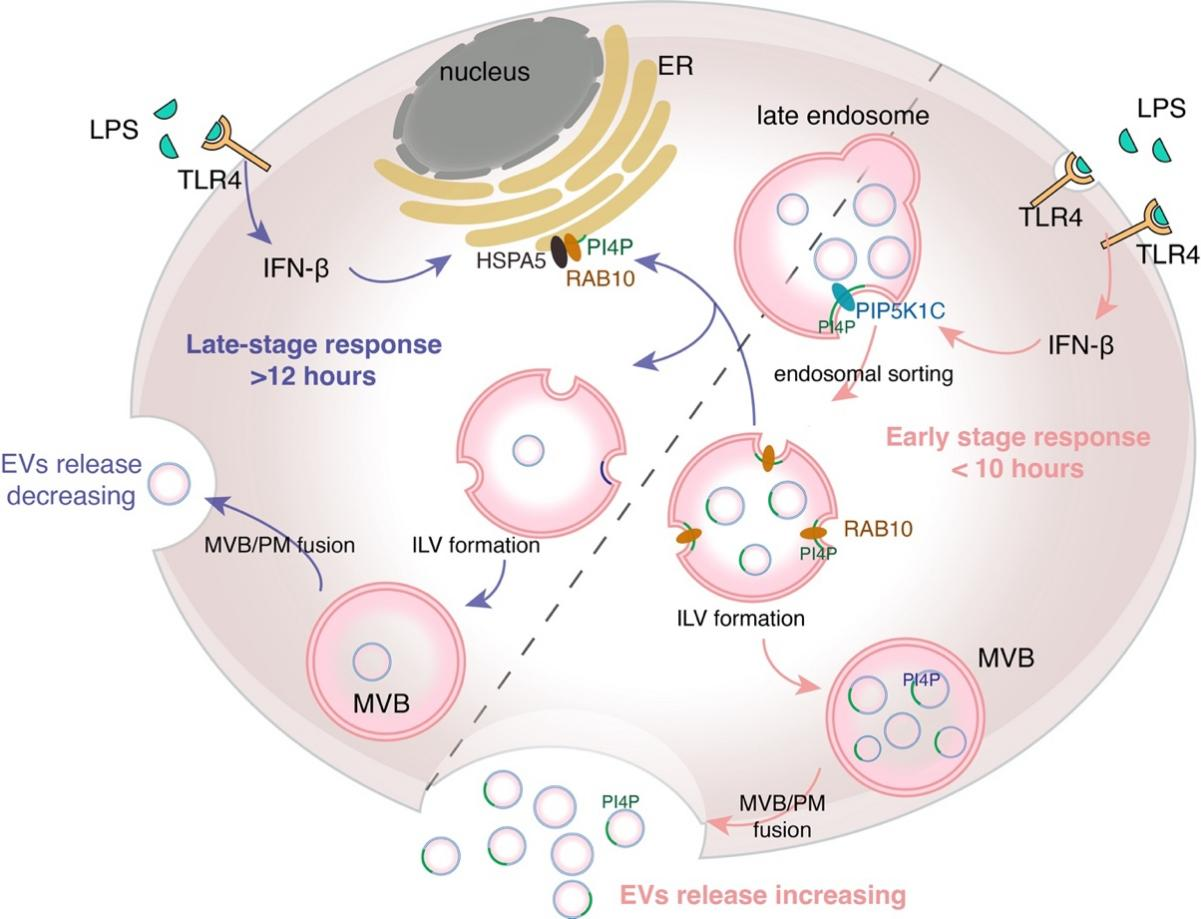
图1 LPS-TLR4 信号通路调节 EVs 释放的分子机制模式图
研究背景
细胞外囊泡(Extracellular Vesicles,EVs)是细胞分泌的磷脂双分子层膜包裹而成的小泡(图1),它不仅是细胞排出垃圾的方式,更在细胞间信号传递中发挥重要功能(1)。Toll样受体(Toll-like receptor, TLR)是天然免疫与适应性免疫之间最重要的桥梁之一,严格的信号传导和时空调控为免疫系统的有序运行提供保障,可有效避免脓毒症等天然免疫疾病的发生(2)。然而,EVs作为重要的细胞间通讯介质,在TLRs信号传递过程中的功能报道尚少,同时TLRs激活是否会调控EVs的生成与释放尚无充分证据。
研究结果
该研究发现,在TLR4激活条件下,巨噬细胞内EVs释放速率随TLR4的配体革兰氏阴性细菌外部细胞壁的一种主要糖脂组分 脂多糖(Lipopolysaccharide,LPS)刺激时间先升高后降低,表现出明显的时间规律。通过与清华大学化学系瑕瑜课题组合作,成功实现对EVs中微量磷脂 磷脂酰肌醇的定量检测,发现介导囊泡生成的磷脂酰肌醇-4-磷酸(Phosphatidylinositol-4-phosphate,PI4P)与EVs的释放速率呈显著正相关关系(图2)。
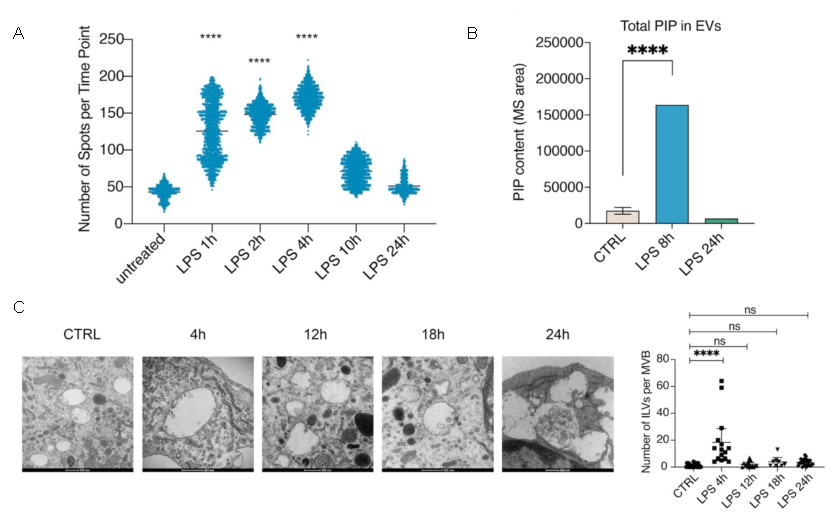
图2 LPS刺激调控EV释放速率变化及EV中PIP含量
探究分子机制发现,LPS刺激短时间内,TLR4激活产生的I型干扰素可调控PI4P激酶表达增加多囊泡体(MVB)上PI4P含量,从而招募下游蛋白促进胞内囊泡(ILV)生成,从而增加EV释放速率;LPS刺激时间增长后,PI4P从MVB减少,从而EVs生成与释放减少。TLR4受体持续性激活所致的过度免疫反应是脓毒血症的主要诱因,EVs所参与的严格时序调控将有效避免信号的持续性激活。
进一步探究EVs释放与LPS刺激信号的关系,发现TLR4天然免疫信号激活后,巨噬细胞内LPS-TLR4下游的TRIF信号通路激活所产生 IFN- ,对PI(4,5)P2激酶PIP5K1C的表达调控实现,通过改变PI4P的定位调控EV的生成(图3)。该结论在巨噬细胞RAW264.7细胞系和C57BL/6J小鼠原代BMDMs生理模型中均表现出一致的调控作用。
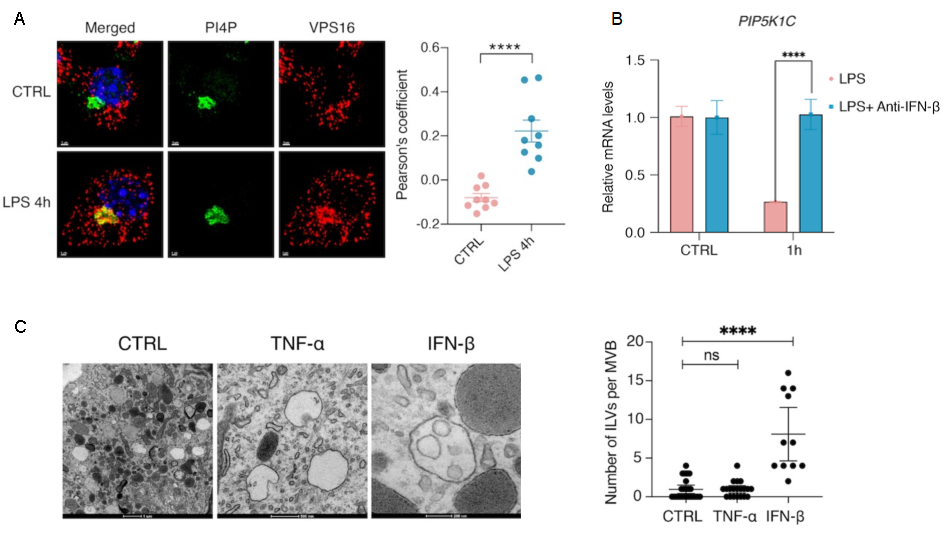
图3 LPS-IFN- 信号通路调控PIP变化及EV前体的生成
研究意义
近年来,由于EV可以实现液体活检以及载药透过血脑屏障等优势,该领域的研究持续升温。天然免疫中EV调控的新机制的发现为疾病的发病机理提供新解释,同时EV生成机制的解析也为其标准化生产提供潜在参考途径。
参考文献
1. G. Raposo et al., B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine 183, 1161-1172 (1996).
2. V. R. Ramirez-Carrozzi et al., A unifying model for the selective regulation of inducible transcription by CpG islands and nucleosome remodeling. Cell 138, 114-128 (2009).
清华大学药学院尹航教授为本文通讯作者,北京大学前沿交叉学科研究院PTN项目2023届博士生靳学为本文第一作者,清华大学瑕瑜教授、张莹博士、2018级博士生夏天以及骆书辰等对为本课题提供重要帮助。感谢国家委、国家科技部重点研发计划、北京市教委提供的经费支持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 《自然·免疫学》:科学家发现,淋巴结是免疫治疗的引爆点 (2025-10-21)
- Cancer Res:免疫细胞也会“双刀流”?科学家教会抗癌战士新招式,专治耐药肠癌 (2025-10-21)
- 上海德达心血管医院成功举办《胸痛的识别和心脏大血管疾病的规范治疗》研讨会 (2025-10-21)
- 第八届(2025)中国医疗器械创新创业大赛人工智能与医用机器人类别赛圆满落幕 (2025-10-21)
- 上海市下降本市部门医疗服务名目价钱的关照 (2025-10-21)
- 青海省集采药品“三进”种类目次(第一批) (2025-10-21)
- 槲皮素哪个牌子效果好?清肺护肺选什么?长期吸烟该怎么选? (2025-10-21)
- 《自然》:发现燃脂备选方案!科学家首次发现,棕色脂肪中还有一条隐秘的备用燃脂通路,代谢性疾病或迎来治疗新靶点 (2025-10-21)
- Nature子刊:四川大学刘肖珩团队递送miRNA精准调控线粒体代谢,治疗动脉粥样硬化 (2025-10-21)
- Chem Biol Interact新突破:HDAC1抑制剂ZJH-1“精准绞杀”前列腺癌,去势抵抗患者终于等来了新曙光 (2025-10-21)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















