复旦大学彭慧胜团队开发基于碳纳米管的仿生人工韧带,让跛脚绵羊恢复奔跑跳跃能力 |
 |
来源:生物世界 2023-05-10 14:56
这项研究表明,仿生自天然韧带结构的、分层排列的碳纳米管纤维与宿主骨骼结合得非常好,并且足够坚固,可以用于生成人工韧带。这种具有多尺度通道结构的人工韧带为解决韧带-骨关节高动态应力载荷修复的迫切临床问题在刚刚故去的五一小长假里, 特种兵式旅游 成为热词。不少人,尤其是年轻人在小长假的几天时间里,挑战用最少的花费和最短的时间游历最多的景点,舟车劳顿之后还要按时回去上班、上课。这种 特种兵式旅游 的日行步数十分惊人,一些不常运动的人很容易发生踝关节扭伤、韧带损伤等。
实际上,韧带损伤发生的概率并不低,经常关注体育赛事的读者都会注意到,许多运动员都因韧带损伤而休赛甚至直接退役。而更令人遗憾的是,目前针对韧带损害的治疗方法十分有限,而且均存在明显的弊端与不足。
2023年5月4日,复旦大学高分子科学系彭慧胜、陈培宁、孙雪梅,以及复旦大学附属中山医院丁琛、复旦大学附属华山医院陈世益等作为共同通讯作者,在Nature子刊Nature Nanotechnology上发表了题为:Hierarchical helical carbon nanotube fibre as a bone-integrating anterior cruciate ligament replacement的研究论文。
该研究开发了一种人工韧带,它具有良好的力学性能,可以与宿主的骨骼结合,恢复其因韧带损伤而受损的运动能力。同时研究团队还在家兔、绵羊中证明了该人工韧带的长期安全性,并研究了其参与整合的途径。

韧带和肌腱由纤维结缔组织组成,对关节的运动和稳定至关重要。韧带连接骨头,而肌腱连接肌肉和骨头。因为这些组织传递高,所以它们必须强壮、灵活和稳定。在剧烈运动中,由有机分子组成的天然韧带很容易受到高负荷损伤。据,每年全世界每1250人就有一人需要手术重建前交叉韧带(ACL)。
自体移植物和同种异体移植物被认为是ACL手术重建的最佳选择,因为它们具有内在的生物活性,可以促进细胞增殖和新组织生长,但它们通常十分稀缺。作为替代品,合成聚合物移植物,如聚对苯二甲酸乙二醇酯(PET)、聚己内酯等,也被设计用于临床实践。然而,这些聚合物移植物具有寿命短、移植失败率高和需要手术翻修等弊端。
值得一提的是,天然韧带组织具有独特、精细和高效的结构:韧带是由纳米大小的胶原原纤维组织成微米大小的胶原纤维和束下束的层次结构,其复杂的排列结构使得韧带足够坚固并转移关节运动产生的高应力负荷。此外,胶原纤维之间的纳米尺度通道也为细胞的附着和增殖提供了良好的环境,促进了间充质(MSC)的募集分化。
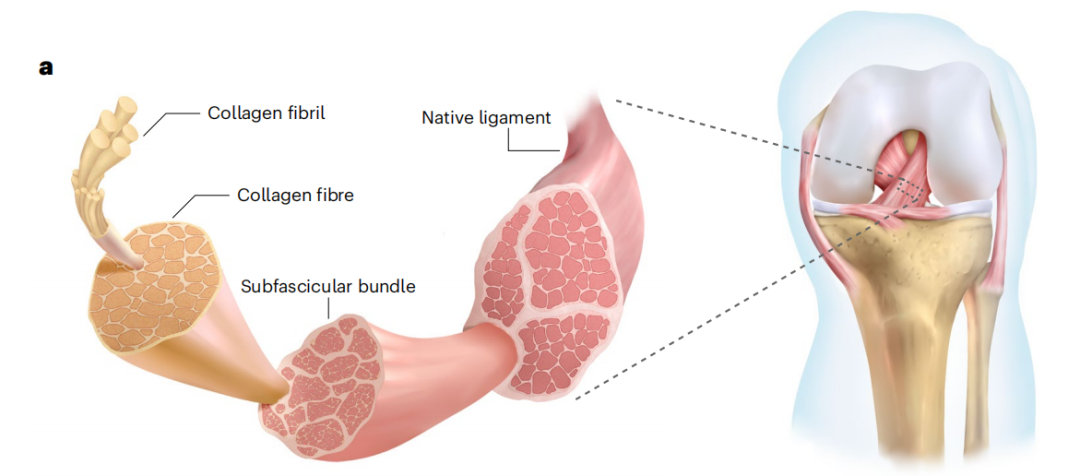
天然韧带的结构示意图
因此,如果我们能使用纳米材料模仿天然韧带组织的这种多尺度通道结构,那么就有可能获得功能强大的人工韧带,同时为细胞和组织的生长提供合适的环境,从而实现有效的生物整合。
在这项研究中,研究团队开发了一种高性能的人工韧带,它由碳纳米管(CNT)组装成分层螺旋纤维(HHF),具有与天然韧带相似的各向异性结构。此外,碳纳米管也赋予这种人工韧带重量轻、抗拉强度高和生物相容性好等优点。

人工韧带由碳纳米管(CNT)组装成分层螺旋纤维(HHF)
具体而言,人工韧带是由排列整齐的碳纳米管组装而成,并形成分层螺旋纤维,同时还带有类似的纳米和微米级多尺度通道。得益于与天然韧带相仿的结构,这种人工韧带不仅具有所需的力学性能,还可以与宿主骨骼结合,恢复宿主的运动能力。
在家兔模型中使用HHF重建前交叉韧带(ACL)
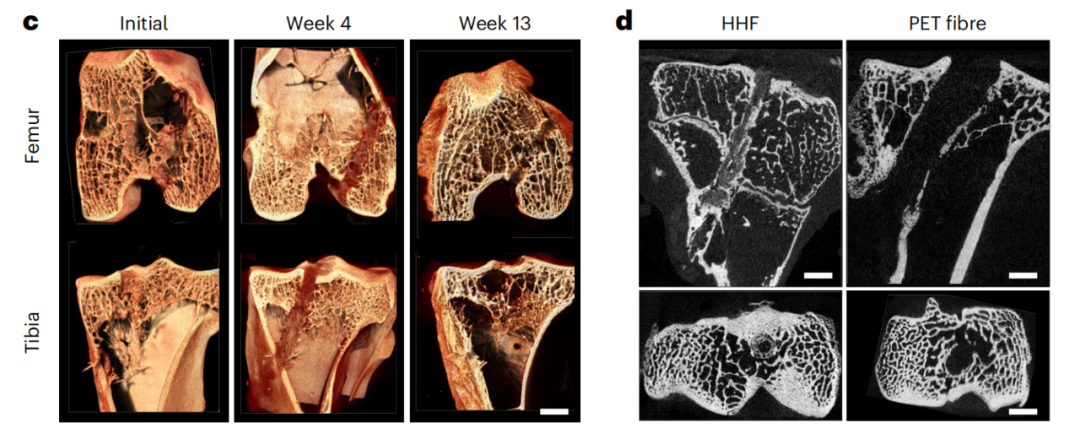
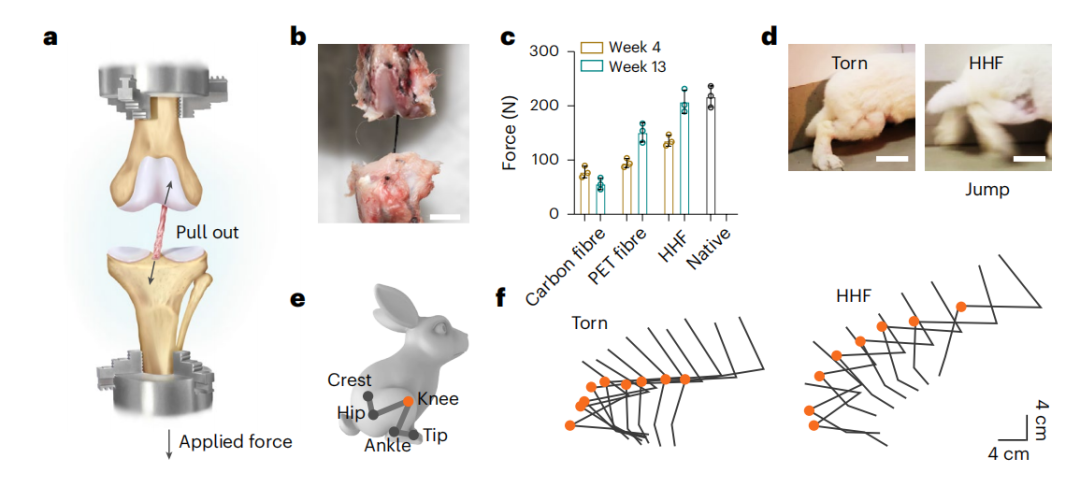
为了量化人工韧带与宿主骨骼之间的界面强度,研究团队测量了拔出力,即从骨骼中拔出HHF植入物所需的结合力,以显示骨结合程度。在移植后的第4周,植入的HHF表现出比同种异体移植物和骨骼之间的拔出力高三倍!并且还会随着时间的推移不断增强!
HHF移植物的生物整合以及与对照相比
组织学结果表明,HHF可以促进成骨细胞和破骨细胞的活性,以增强骨骼建模和重塑,并且在骨整合的早期阶段,HHF周围和内部可以逐渐形成胶原束。不仅如此,HHF的微米通道还可以促进和神经的形成,这在PET移植物中很少发生。
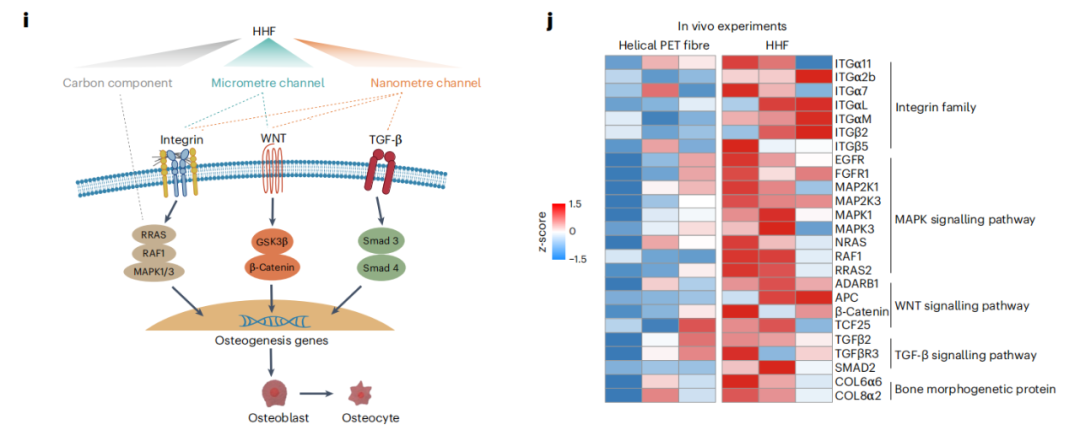
HHF促进骨骼重塑
更重要的是,在兔、羊的前交叉韧带(ACL)重建模型中,移植人工韧带13周后,其受伤部位所能承受的压力明显增强,并恢复正常站立、行走、奔跑和跳跃等运动能力。此外,系统的实验分析表明,人工韧带可以在体内长期使用,并具有良好的生物相容性和安全性。
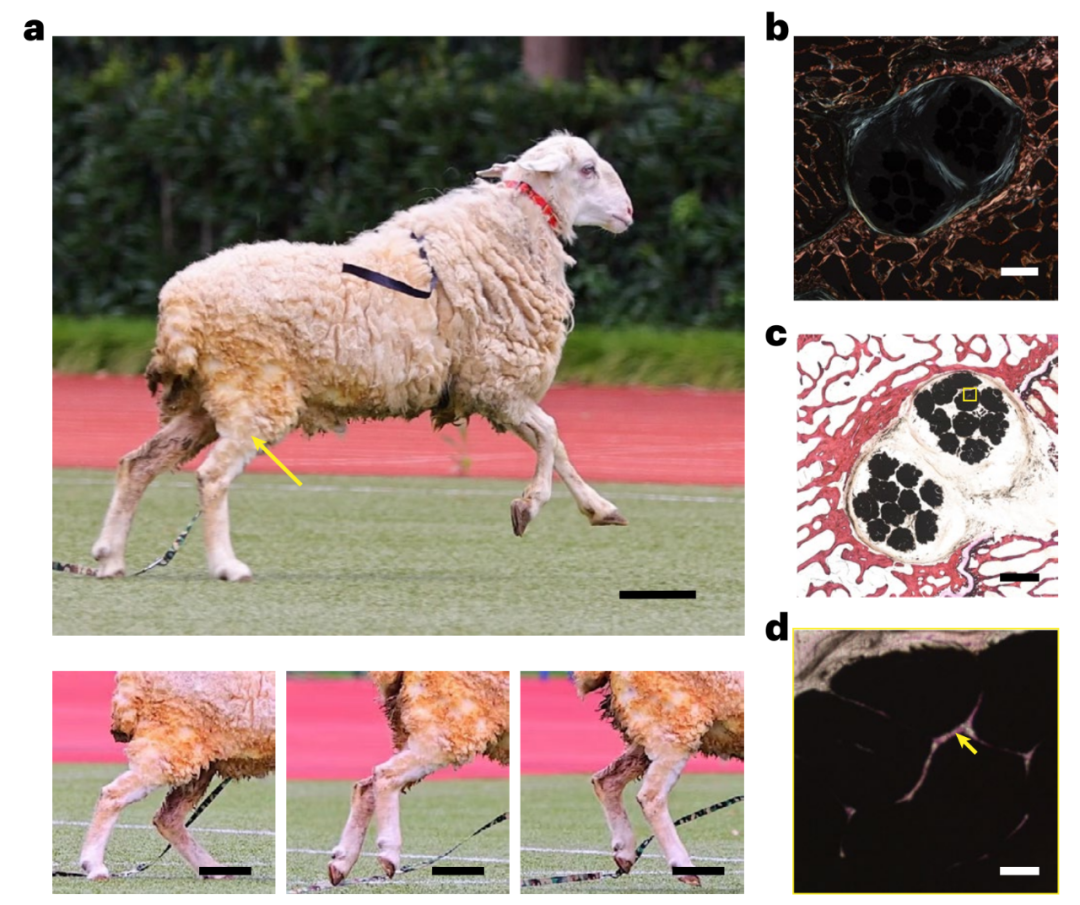
在大型动物(绵羊)模型中,使用HHF移植物重建ACL可以恢复受伤动物的运动能力
总而言之,这项研究表明,仿生自天然韧带结构的、分层排列的碳纳米管纤维与宿主骨骼结合得非常好,并且足够坚固,可以用于生成人工韧带。这种具有多尺度通道结构的人工韧带为解决韧带-骨关节高动态应力载荷修复的迫切临床问题开辟了新的途径。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 赛诺菲胰岛素原料药项目启动,助力北京打造全球医药健康产业高地 (2025-10-18)
- Nature Medicine:首次人体实验,PD-1单抗治疗艾滋病 (2025-10-18)
- 百年药企参天公司旗下维生素B12滴眼液参天玫瑰®焕新上市 (2025-10-17)
- 神经元只负责“干活”?Nature:星形胶质细胞才是记忆“保存总监”,双重认证锁死重要记忆 (2025-10-17)
- 赛诺菲胰岛素原料药项目启动,助力北京打造全球医药健康产业高地 (2025-10-17)
- Nat Cell Biol:结肠癌也“分地段”?科学家找到决定癌症位置的“源头细胞” (2025-10-17)
- 干细胞变“唾液腺修复贴片”!Stem Cell Reports证实:人诱导多能干细胞来源细胞片可与损伤腺体整合,为口干症治疗开辟新路径 (2025-10-17)
- 律动不息 上海德达心血管医院开展2025世界心脏日系列护心活动 (2025-10-17)
- 科研人员开放染色质互作新技术并鉴定人类胎脑的独特基因空间调控模式 (2025-10-17)
- 《癌症研究》:空军军医大学团队发现,肠癌细胞释放外泌体重编程成纤维细胞,驱动结直肠癌转移 (2025-10-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















