JITC:科学家发现二甲双胍抗癌新机制!瘤内T细胞缺氧,二甲双胍能救场 |
 |
近日,由
近日,由比利时鲁汶大学Benoit J Van den Eynde和Veronica Finisguerra领衔的研究团队,在著名期刊《癌症治疗杂志》(JITC)发表重要研究成果[1]。
他们发现,可以通过减少活性氧产生的方式,将CD8阳性T细胞从缺氧引起的细胞凋亡和免疫抑制中解救出来,增强T细胞的增殖和细胞因子的产生,抑制PD-1和LAG-3表达的上调。
重要的是,二甲双胍能在不同的肿瘤模型中增强肿瘤对免疫疗法的反应。

论文首页截图
缺氧是大多数实体瘤的共同特征。
瘤内缺氧不仅会降低CD8阳性T细胞的抗癌能力,甚至还会将CD8阳性T细胞排除在缺氧的肿瘤区域之外。因此,改善CD8阳性T细胞在缺氧条件下的生存能力和效应功能,或许能改善肿瘤对免疫治疗的反应。
Finisguerra和她的同事们注意到,早在几年前就有研究发现,二甲双胍可以保护肿瘤浸润性CD8阳性T细胞免于凋亡和耗竭[2],但背后的分子机制仍不明确。因此,她们想知道二甲双胍的这种保护作用是不是与抗缺氧有关。
她们先在小鼠体内采集CD8阳性T细胞,将它们放在正常条件下培养4天,然后分别转移到氧气含量为21%或1%的环境中培养1-3天。不同氧气条件下培养的T细胞长势差别很明显,与常氧环境培养的T细胞相比,暴露在缺氧环境中的T细胞数量和扩增量减少;不仅如此,缺氧还增加了T细胞凋亡,减少了T细胞的增殖。
有意思的是,当用二甲双胍处理CD8阳性T细胞时,缺氧环境中培养的T细胞数量和增殖的减少,以及T细胞凋亡的情况得到了部分缓解。这表明,二甲双胍可能直接改善了CD8阳性T细胞在缺氧条件下的生存能力。

二甲双胍对T细胞的增殖和凋亡的影响
二甲双胍的作用远不止这些。
Finisguerra还发现,缺氧导致的T细胞免疫检查点标志物PD-1和LAG3表达增加,也能被二甲双胍抑制。此外,缺氧导致的T细胞干扰素(IFN)- 和肿瘤坏死因子(TNF)- 产生减少,也能被二甲双胍逆转。

二甲双胍对T细胞功能的影响
这些初步研究结果表明,二甲双胍对暴露于缺氧环境中的CD8阳性T细胞有直接好处,通过下调耗竭标志物的表达和增强细胞因子的产生,将T细胞从生长停滞和凋亡中解救出来,并恢复CD8阳性T细胞的效应功能。
在体内试验中,Finisguerra采用了过继细胞治疗(ACT)黑色素瘤小鼠模型。结果发现,在饮用水中加入二甲双胍之后,CD8阳性T细胞浸润肿瘤的能力增加,尤其是对肿瘤缺氧区的浸润。如果将二甲双胍和环磷酰胺(CTX)联合使用的话,会进一步提高浸润T细胞在肿瘤缺氧区的持久性和存活率,从而提高肿瘤对免疫治疗的反应。
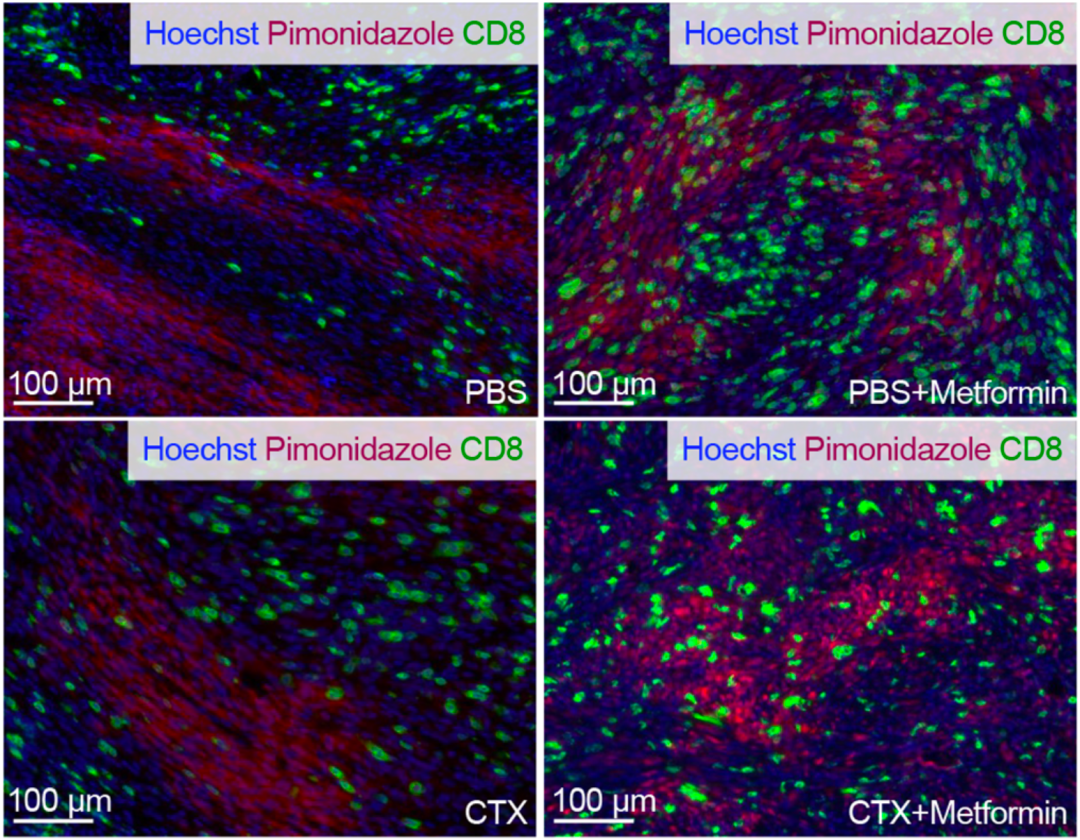
二甲双胍对T细胞浸润肿瘤的影响
体外和体内实验都证实了二甲双胍促进T细胞对缺氧耐受的作用,Finisguerra等的研究进一步揭示了背后的分子机制,原来二甲双胍可以减少缺氧时CD8阳性T细胞内ROS的积累,防止线粒体功能紊乱和氧化性DNA损伤,从而直接改善CD8阳性T细胞的生存和功能。
随后Finisguerra和她的同事又在人体CD8阳性T细胞中复现了上述研究结果,证实二甲双胍对人体CD8阳性T细胞有类似的作用。
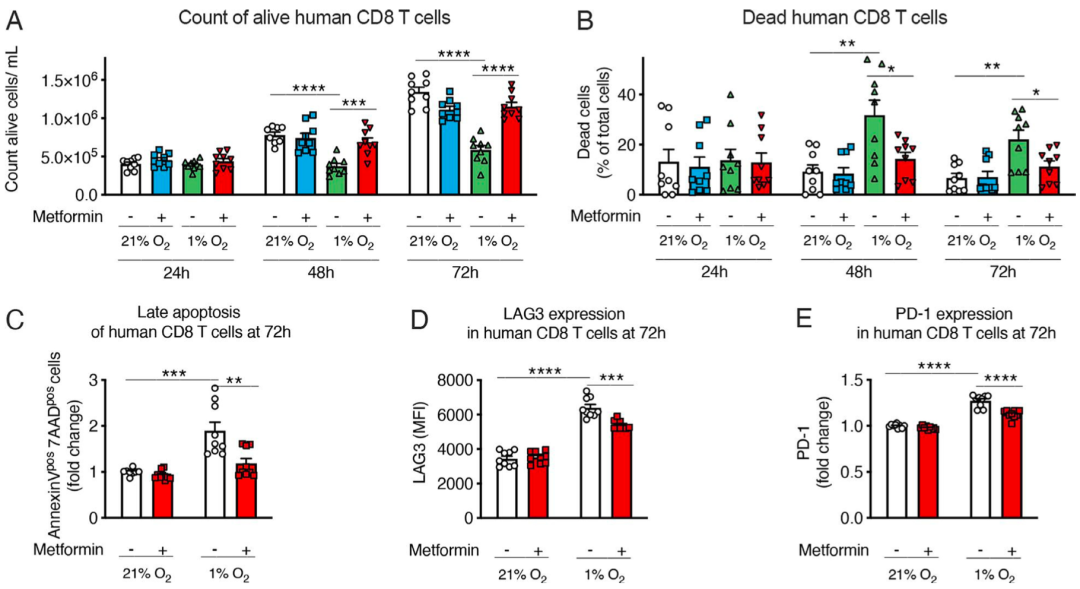
二甲双胍对缺氧人CD8阳性T细胞的影响
在研究的最后,Finisguerra和她的同事探索了二甲双胍和PD-1抑制剂联用的效果。
在对PD-1抑制剂耐药的B16F1黑色素瘤小鼠模型中,二甲双胍联合CTX预处理让肿瘤对PD-1抑制剂有了反应。不过,二甲双胍联合PD-1抑制剂没有影响CD8阳性T细胞的浸润,而是增加了肿瘤缺氧区CD8阳性T细胞的存活率。
在对PD-1抑制剂敏感的MC38小鼠模型中,与单独使用PD-1抑制剂治疗相比,二甲双胍的加入增强了PD-1抑制剂抗肿瘤的能力,让11只小鼠中的8只肿瘤消失,而单独使用二甲双胍或抗PD-1治疗的小鼠中,分别仅有1只(1/9)或4只(4/9)实现了肿瘤消失。
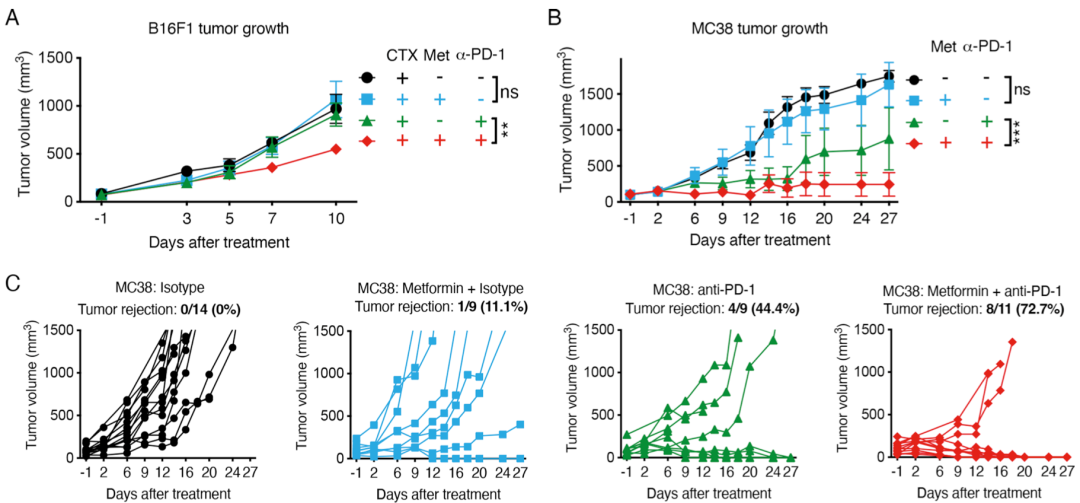
二甲双胍能增强PD-1抑制剂的抗肿瘤能力
总的来说,Finisguerra团队的这项研究揭示了二甲双胍抑制肿瘤浸润CD8阳性T细胞凋亡和耗竭的分子机制,发现了二甲双胍能促进CD8阳性T细胞对缺氧耐受的全新机制。
更重要的是,她们发现二甲双胍的这一作用可以在体内和人体细胞中复现,这对于改善免疫治疗的临床效果有重要的意义。
值得一提的是,在去年10月份,加拿大多伦多大学的研究人员基于2期临床试验发现,[3],不过背后的机制也不明确。
将这两个研究结合起来看,二甲双胍对于缺氧的实体瘤可能有潜在的双重作用,值得在缺氧的实体瘤中开展更深入的研究。
参考文献:
[1].Finisguerra V, Dvorakova T, Formenti M, et al. Metformin improves cancer immunotherapy by directly rescuing tumor-infiltrating CD8 T lymphocytes from hypoxia-induced immunosuppression. J Immunother Cancer. 2023;11(5):e005719. doi:10.1136/jitc-2022-005719
[2].Eikawa S, Nishida M, Mizukami S, Yamazaki C, Nakayama E, Udono H. Immune-mediated antitumor effect by type 2 diabetes drug, metformin. Proc Natl Acad Sci U S A. 2015;112(6):1809-1814. doi:10.1073/pnas.1417636112
[3].Han K, Fyles A, Shek T, et al. A Phase II Randomized Trial of Chemoradiation with or without Metformin in Locally Advanced Cervical Cancer. Clin Cancer Res. 2022;28(24):5263-5271. doi:10.1158/1078-0432.CCR-22-1665
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 明眸皓齿打一个正确的生肖,最佳资询落实 (2025-09-13)
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















