Mol Cell |
 |
在前期的研究中,作者观察到长3 UTR转录本会滞留于nuclear speckles(核斑)。考虑到m6A修饰复合物的组分也在nuclear speckles富集,作者提出假设:滞留于nuclear speckles的长3 UTR转录本会进一步在转录后发生m6A修饰,从而造成m6A修饰水平和RNA的3 UTR长度呈正相关;而通过sequential polyadenylation的第二步切割,则会造成同一个基因的短3 UTR转录本而不是长3 UTR转录本被m6A所修饰。由于以前的报道认为m6A修饰主要是共转录发生的,作者首先鉴定了m6A修饰能否在转录后进一步发生?为此,作者在前人开发的m6A-LAIC-seq【3】和GLORI【4】的基础上,结合新生RNA标记技术,开发了4sU-m6A-LAIC-seq和4sU-GLORI方法。通过比较新生(nascent)RNA,包括无polyA尾和带有polyA尾的新生RNA,以及稳定状态(steady-state)下的RNA的m6A水平,作者发现转录后m6A修饰是一个普遍的现象(图2),而且相比较于未发生转录后m6A修饰的RNA,发生转录后m6A修饰的RNA在稳定状态下m6A修饰水平更高。
进一步,作者为了证明RNA的核滞留能够增强m6A修饰水平,一方面构建了HBB-gDNA(含有intron)和HBB-cDNA(不含intron)报告质粒:两个reporter最终产生的RNA序列完全一样,但只有HBB-gDNA来源的RNA能够有效转运出核,而HBB-cDNA来源的RNA则会滞留于细胞核内;另一方面,利用AID2系统对mRNA转运出核因子NXF1进行快速降解以诱导mRNA核滞留。
随后,分别对Reporter来源的 RNA和内源基因来源的RNA进行GLORI定量。单个reporter和转录组规模的实验结果都证明了RNA的核滞留确实能够提高m6A的修饰水平,这也暗示着长3 UTR也有可能通过RNA核滞留增强m6A修饰水平。鉴于渐进式可变多聚腺苷酸化的发生是由于近端polyA位点弱于远端polyA位点,作者进一步通过改变近端polyA位点的强度以破坏或保留渐进式可变多聚腺苷酸化的发生,得到的实验结果进一步表明渐进式可变多聚腺苷酸化可以促进m6A修饰。
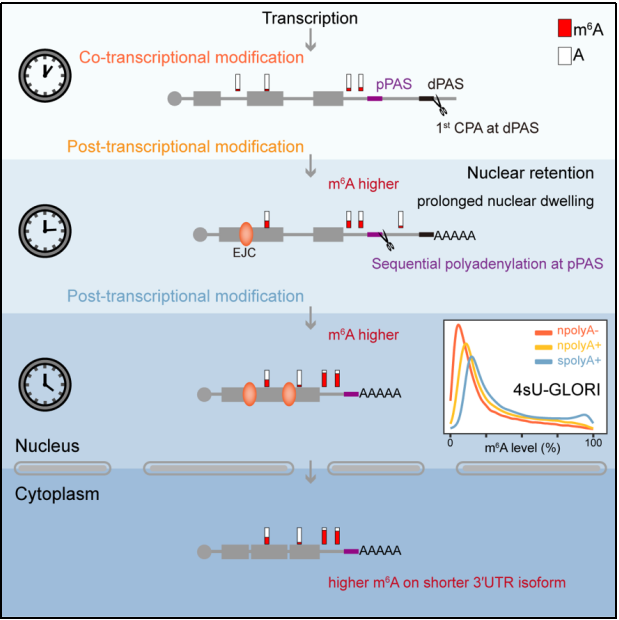
渐进式多聚腺苷酸化与核滞留共同决定转录后m6A修饰(Credit:Molecular Cell)
综上,该研究提出了渐进式多聚腺苷酸化与核滞留共同决定转录后m6A修饰的新机制:在渐进式多聚腺苷酸化过程中,远端polyA位点加工产生的长3 UTR转录本滞留于细胞核内,额外的核滞留时间使得m6A修饰复合物可以在转录后对mRNA继续进行修饰,从而进一步提高其m6A修饰水平(图2)。该研究为理解m6A等修饰与APA调控提供了新思路,为解决领域冲突提供了新视角。
医药网新闻
- 相关报道
-
- 《细胞》:帕金森病治疗再获突破!韩国科学家发现,人胚胎干细胞衍生多巴胺祖细胞移植,可以改善运动症状,且高剂量疗效更佳 (2025-10-17)
- Nature:科学家有望开发出针对特殊甲型流感病毒的广谱疫苗 (2025-10-17)
- Sci Adv:细胞里的“能源局长”被发现了!帕金森病治疗有望迎来新曙光 (2025-10-17)
- 【MADI·美械会】日程抢先看!免费门票限时领!评审中心 / 研发企业 / 临床机构齐聚苏州! (2025-10-16)
- 人类皮肤可以产生卵子?!最新Nature子刊:科学家成功将人体皮肤细胞的染色体“减半”,制造出类卵细胞结构 (2025-10-16)
- 面对输赢,男性赢了还想赢,女性赢了却偏向“见好就收”?最新Neuron|原来都是大脑PV神经元在暗中操控! (2025-10-16)
- 《柳叶刀》子刊:戒烟对认知有重要意义!最长18年随访研究显示,戒烟者的长期认知轨迹较吸烟者更好 (2025-10-16)
- 破局之“法”!通过重构宫颈癌供血系统,法米替尼“一箭双雕”,既直接抗癌又协同增效免疫治疗 (2025-10-16)
- Nature Biotechnology:基因“静音”的艺术?不“剪”基因,我们如何实现精准长效的疾病调控 (2025-10-15)
- Cell重磅:人类胚胎干细胞来源的多巴胺能前体细胞,安全有效治疗帕金森病 (2025-10-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















