ACS Nano:陈春英团队利用纳米水凝胶干扰外泌体通讯,对抗肿瘤免疫适应性 |
 |
来源:生物世界 2024-11-10 10:45
该研究利用靶向肿瘤细胞膜的短肽纳米纤维材料,通过干扰肿瘤外泌体通讯,抑制肿瘤免疫微环境中的肿瘤适应性。近日,国家纳米科学中心陈春英院士课题组在ACS Nano 期刊发表了题为Hydrogel-Mediated Jamming of Exosome Communications That Counter Tumor Adaption in the Tumor Immune Microenvironmen的研究论文。
该研究利用靶向膜的短肽纳米纤维材料,通过干扰肿瘤外泌体通讯,抑制肿瘤微环境中的肿瘤适应性。该研究首次报道了通过在乏氧肿瘤细胞表面形成纳米纤维状水凝胶结构,抑制肿瘤外泌体扩散,同时携带碳酸酐酶IX(CA IX)抑制剂以缓解肿瘤低氧环境,最终增强免疫系统对肿瘤的杀伤能力,实现治疗过程中更高效的肿瘤微环境时空控制治疗策略。

陈春英院士团队与合作团队在高效低毒抗肿瘤纳米药物的研制及作用机制研究方面已获得一系列进展。该团队前期研究已获得一种特异性杀伤乏氧肿瘤细胞的自组装短肽纳米纤维材料。该材料通过靶向乏氧肿瘤细胞膜上的CA IX酶并发生自组装,特异性杀伤乏氧肿瘤细胞。在该研究基础上,团队进一步通过在乏氧肿瘤细胞表面形成纳米纤维状水凝胶结构,抑制肿瘤外泌体扩散,同时携带CA IX抑制剂以缓解肿瘤低氧环境,最终提高免疫系统对肿瘤的浸润与杀伤能力,以此全面改善肿瘤及其转移微环境,提升抗肿瘤作用效果。
当前纳米技术为我们提供多种智能策略来对抗乏氧的肿瘤微环境,然而,通过切断肿瘤内部及远距离通讯,实现肿瘤微环境全面改善的治疗方式仍有待系统探索与研究。基于此,陈春英院士团队设计了一种靶向肿瘤细胞膜的磷酸酶响应型短肽自组装分子(PepABS-py)。该研究显示,它能在肿瘤细胞膜表面形成水凝胶,有效捕捉并抑制肿瘤细胞释放的外泌体,阻止其在肿瘤微环境中的传播,以及对微环境的产生调节作用。
在乏氧肿瘤微环境中,水凝胶对肿瘤外泌体中的miRNA表达产生了显著调控,特别是在T细胞信号传导过程中,增强了CD8+T细胞的增殖与浸润,改善了肿瘤内部的免疫抑制微环境,从而进一步减弱肿瘤在乏氧微环境下的适应能力。
值得关注的是,在与化疗药物联用时,该水凝胶材料还能显著限制肿瘤细胞与其它器官之间的远距离交流,有效重塑远端肺组织中的免疫与炎性微环境,抑制化疗刺激诱导的肿瘤细胞转移风险。
综上所述,该研究展示了通过水凝胶阻断肿瘤外泌体通讯从而抑制肿瘤适应性的新策略。不仅提高了抗肿瘤免疫反应,还在体内实验中展现出降低和增强化疗效果的潜力,具有重要的临床应用前景。
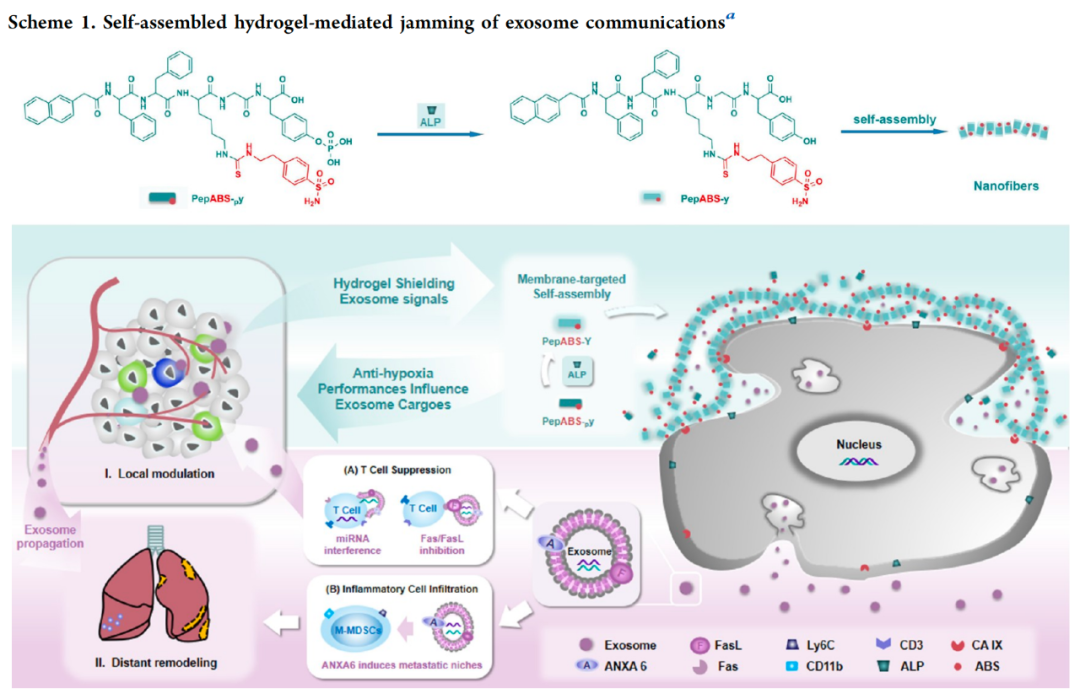

自组装水凝胶介导的外泌体通讯干扰
国家纳米科学中心博士后史可鉴、博士生付文娇、博士生Zeinab Farhadi Sabet为该文共同第一作者,陈春英院士为论文最后通讯作者,李佳阳博士为论文共同通讯作者,该研究得到国家重点研发计划、国家和中国科学院战略性先导科技专项等项目支持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature Biotechnology:合成生物学新里程碑——DIAL框架下的启动子编辑新策略,实现基因表达的“无级变速” (2025-10-19)
- Science:我们与线粒体的古老契约——细胞如何清理“坏基因”? (2025-10-19)
- Nature:解剖代谢“双城”——AI深度学习揭示肝肠内部的功能新图景 (2025-10-18)
- JEM:黄波/张晓辉团队破解JAK2V617F突变引发血小板抑或红细胞增多的分子机制 (2025-10-18)
- 利奥制药在中国递交上市许可申请,持续推进Anzupgo®(德戈替尼乳膏)的全球可及 (2025-10-17)
- Nature:破解遗传密码!汉族人群多基因风险评分的突破性研究 (2025-10-17)
- Nature 揭秘大脑“我意已决”的瞬间:AI 抓包大脑“关门拒听”瞬间,神经轨迹突然大转弯 (2025-10-17)
- 医工“破界”立异:为安康守护按下“快进键” (2025-10-17)
- 国度医保局:全面推动医保基金即时结算改造扩面提质 (2025-10-17)
- 医疗东西监管律例轨制研讨任务漫谈会在新疆召开 (2025-10-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















