Science:中国博后一作,发现mRNA稳定调控新机制——tRNA在翻译过程中调控mRNA降解 |
 |
在mRNA翻译为蛋白质的过程中,
在mRNA翻译为蛋白质的过程中,转运RNA(tRNA)负责识别mRNA上的每个密码子,并将对应的氨基酸添加到多肽链,再进一步折叠、修饰为蛋白质。
而 Science 期刊发表的一项最新研究发现了tRNA的全新作用 在翻译过程中调控mRNA降解。
近期,德克萨斯大学西南医学中心Joshua Mendell 教授团队(博士后朱小强为第一作者)在国际顶尖学术期刊 Science 上发表了题为Specific tRNAs promote mRNA decay by recruiting the CCR4-NOT complex to translating ribosomes 的研究论文。
该研究通过冷冻电子显微镜和tRNA突变实验发现,解码精氨酸密码子的特异性tRNA直接将CCR4-NOT复合体招募到正在翻译的核糖体,启动mRNA降解,从而促进mRNA周转。相反,还有一些tRNA具有阻止CCR4-NOT复合体募集的结构特征。
该研究发现了tRNA在翻译过程中调控mRNA降解的新作用 P位点tRNA介导的mRNA降解(P-site tRNA mediated mRNA decay),扩展了tRNA的已知功能,揭示了调控哺乳动物细胞中mRNA稳定性的新机制,这一机制对于调控基因表达至关重要,尤其是线粒体相关mRNA,因此,这一发现可能为线粒体遗传病、肥胖症以及癌症等线粒体相关疾病提供新的治疗方法。

许多RNA结合蛋白和调节性RNA通过与特定信息结合并招募降解因子(包括CCR4-NOT复合物)来促进mRNA降解,CCR4-NOT复合物通过去除mRNA的poly(A)尾使其不稳定。
最近有研究表明,当翻译效率低下时,CCR4-NOT复合物也可以直接募集到核糖体。具体而言,当核糖体遇到含有有限同源tRNA的密码子(非最优密码子)时,它可能会以空的A位点(A-site)和E位点(E-site)的构项暂停下来。这使得CCR4-NOT复合物的一个亚单位CNOT3与空的E位点结合,从而促进mRNA的降解和加速周转。
对人HEK293T细胞中与CNOT3结合的核糖体相关的mRNA印记进行高通量测序发现,在A位点缓慢解码的密码子的存在并不是核糖招募CNOT3的强信号。相反,P位点的特定精氨酸密码子(CGG、CGA和AGG)与CNOT3的招募高度相关,而其他密码子(包括指定天冬酰胺、赖氨酸、异亮氨酸、酪氨酸、苯丙氨酸、甲硫氨酸和苏氨酸的密码子)则从结合CNOT3的核糖体的P位点被消耗。
mRNA半衰期的测量和mRNA密码子含量的分析表明,编码线粒体核糖体蛋白的mRNA高度富集了CNOT3相关的精氨酸密码子,因此,CCR4-NOT复合物是一个强大的线粒体翻译和质量的负调控因子。
研究团队表示,由于线粒体相关mRNA受这种新发现的mRNA降解机制的影响最为严重,将来有望利用这种降解机制来治疗某些遗传性线粒体疾病以及其他线粒体发挥关键作用的疾病(例如肥胖症和癌症)。
为了研究P位点密码子身份如何调控CNOT3招募,研究团队对含有CGG精氨酸密码子的CNOT3结合的核糖体进行了冷冻电镜分析,结合tRNA和CNOT3的突变,产生的高分辨率冷冻电镜结构揭示了P位点tRNA在CNOT3招募中的核心作用。
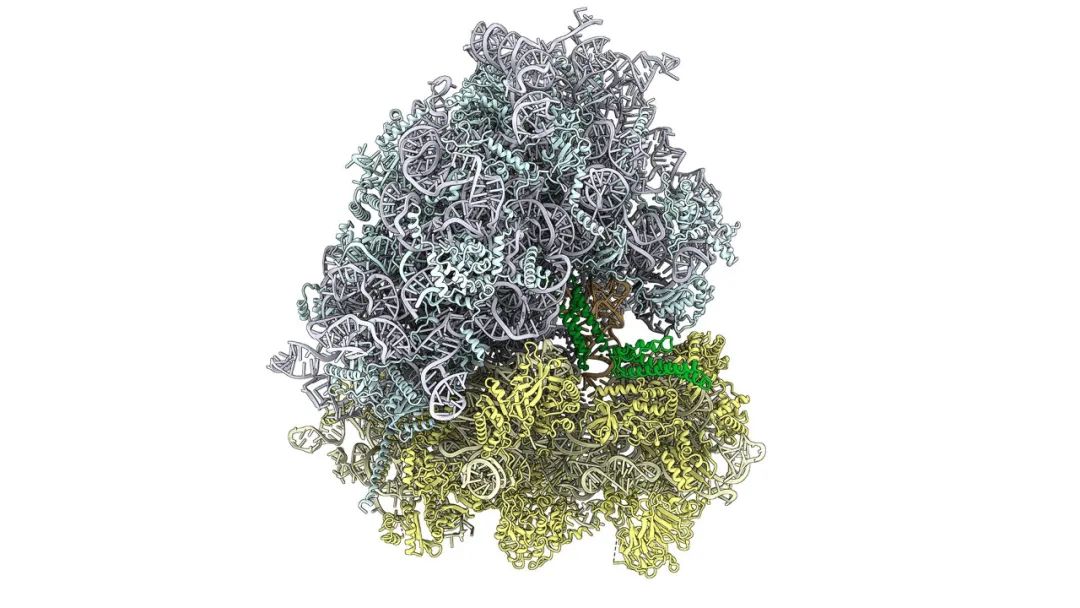
核糖体的分子模型(蓝色和黄色),CCR4-NOT复合物的一部分(绿色)结合在E-位点,识别P-位点的特异性精氨酸tRNA(橙色)。
具体来说,CNOT3进入空的E位点,与P位点tRNAArg,CCG的D臂(D-arm)形成氢键相互作用。这些促进CNOT3募集的相互作用依赖于解码CGG、CGA和AGG的精氨酸tRNA中罕见的U13:A22:A46三联体的存在。此外,解码从CNOT3结合核糖体中缺失的密码子的tRNA通常在D环(D-loop)中含有一个额外的核苷酸,该核苷酸与CNOT3发生空间冲突,从而阻止其募集。
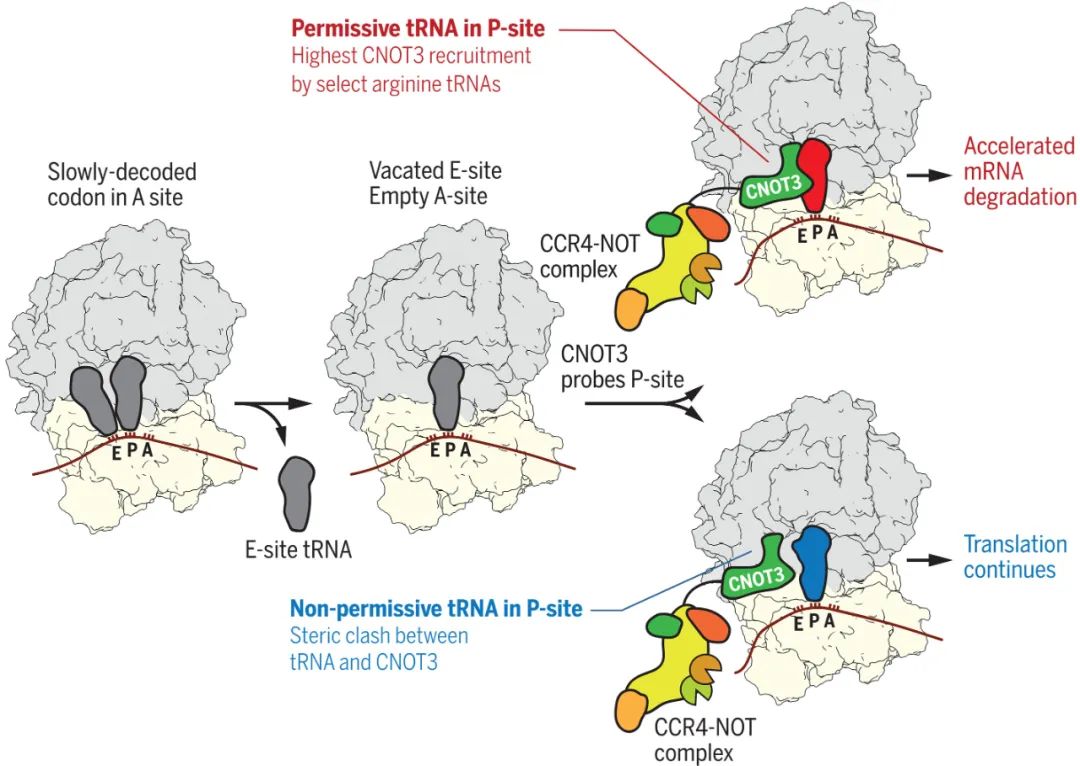
P位点tRNA控制着CCR4-NOT复合体向翻译中的核糖体的募集。缓慢解码导致核糖体具有空的A位点和E位点,为CNOT3进入E-位点并探测P-位点tRNA提供了机会,精氨酸特异性tRNA稳定CNOT3的募集并促进mRNA的降解,而其tRNA在空间上阻断CNOT3的结合,使mRNA能够继续翻译。
总的来说,该研究揭示了tRNA除了在mRNA解码中发挥经典作用外,还参与了翻译中的核糖体招募转录调控因子,从而促进mRNA降解,加速其周转。研究团队提出了P位点tRNA介导的mRNA降解(P-site tRNA mediated mRNA decay)来描述这种mRNA加速周转的新机制。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:揭示小细胞肺癌劫持神经元突触从而加速生长背后的分子机制 (2025-09-12)
- Nat Commun:口腔微生物界的“超级英雄”!科学家揭示细胞外遗传元素Inocle的发现与意义 (2025-09-12)
- Trends Biotechnol.:武汉大学陈刚/余自力等团队提出FACTORY全自动 EV 分离平台,把 EV 分离从“小作坊”直接升级成“标准化工厂” (2025-09-12)
- EMBO Mol Med:罕见基因突变有望揭示肠道干细胞的再生奥秘 (2025-09-11)
- STTT:打断肿瘤的“狗腿”!科学家发现,抑制中性粒细胞的STAT3,会让中性粒细胞“改邪归正”,促进T细胞抗癌 (2025-09-11)
- Cell:IL-25诱导的记忆2型固有淋巴细胞,强化黏膜免疫 (2025-09-11)
- Nature Medicine:靶向休眠肿瘤细胞,预防乳腺癌复发 (2025-09-11)
- PLoS Biol:肠道真菌与人类健康——科学家揭秘基因与微生物的神秘联系! (2025-09-11)
- Nature重磅:“装甲型”CAR-T治疗实体瘤新突破,细胞因子精准“爆破”且全身毒性归零 (2025-09-11)
- 【9·10致敬全体教师】2025细胞外囊泡大会(厦门站)免费票速抢!! (2025-09-10)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















