Science:在分子水平上揭示细菌核糖体招募mRNA的机制 |
 |
来源:100医药网 2024-12-03 10:09
研究者开发了一个机理框架,展示了这种复合物的各种成分如何协同作用,将新转录的 mRNA 带到核糖体上,并在转录和翻译之间发挥桥梁作用。在细胞内,DNA 携带着制造蛋白的遗传密码。为了制造蛋白,细胞会对DNA进行转录而产生 mRNA。然后,一种叫做核糖体的分子机器读取 mRNA,将其翻译成蛋白。但是这个步骤一直是个视觉谜团;科学家们以前并不知道核糖体如何附着到 mRNA上并读取它。
如今,在一项新的研究中,来自法国国家科学研究中心、法国国家健康与医学研究院、斯特拉斯堡大学和密歇根大学研究人员等研究机构的研究人员利用先进的显微镜,对细菌核糖体在一种叫做RNA聚合酶(RNAP)的酶将DNA转录为mRNA时mRNA如何被招募到mRNA上进行了成像。相关研究结果发表在2024年11月29日的Science期刊上,论文标题为 Molecular basis of mRNA delivery to the bacterial ribosome 。

论文共同通讯作者Albert Weixlbaumer说, 了解核糖体如何捕获或 招募 mRNA是接下来发生的所有事情的先决条件,比如了解核糖体如何开始mRNA中编码的信息。这就像一本书。你的任务是阅读和解释一本书,但你不知道从哪里得到这本书。这本书是如何送到读者手中的?
作者发现,用于将DNA转录为mRNA 的 RNAP 部署了两个不同的锚,以拴住核糖体,确保站稳脚跟并开始蛋白合成。这就好比建筑工地上的工头监督工人安装上层建筑的复杂部分,用两种冗余的方式确认所有部件在关键的连接点都被牢牢固定,以实现最大的稳定性和功能性。
作者表示,了解这些基本过程为开发靶向细菌蛋白合成中这些特定途径的新型提供了巨大潜力。传统上,抗生素靶向核糖体或RNAP,但细菌往往能找到进化和变异的途径,从而对这些抗生素产生抗药性。有了这些新的知识,他们希望通过切断多种途径来战胜细菌。
论文共同第一作者Adrien Chauvier说, 我们知道,RNAP、核糖体、转录因子、蛋白和 mRNA 之间存在相互作用。我们可以靶向这个界面,特别是 RNAP、核糖体和 mRNA 之间的界面,比如通过使用一种化合物来干扰这种复合物的招募或稳定性。
他们开发了一个机理框架,展示了这种复合物的各种成分如何协同作用,将新转录的 mRNA 带到核糖体上,并在转录和翻译之间发挥桥梁作用。
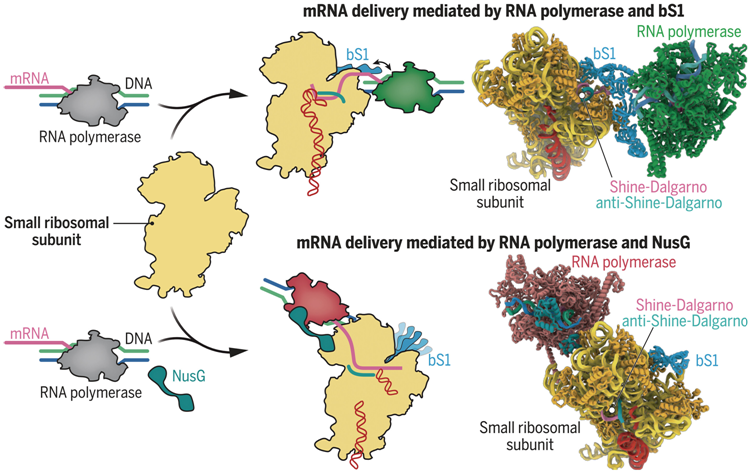
核糖体招募mRNA的早期步骤
RNAP(灰色)以DNA为模板合成mRNA(粉色)。核糖体小亚基(黄色)通过两种途径被募集到mRNA。首先,RNAP(绿色)与核糖体蛋白bS1(青色)接触,后者将mRNA结合并引导至anti-SD基序(顶部)。或者,NusG( 青色)在核糖体进入通道(底部)附近拴住RNAP(红色)。翻译起始因子促进翻译起始进行(未示出)
Weixlbaumer 说, 我们想知道 RNAP 和核糖体的耦合是如何建立起来的。我们利用纯化的成分,重新组装了这种直径为十亿分之一米的复合物。我们利用低温电镜(cryo-EM)观察到它们的动作,并解释了它们在做什么。然后,我们需要看看我们纯化的成分的行为能否在不同的实验系统中重现。
在更复杂的人类细胞中,DNA 位于核膜包围的细胞核中,RNAP 在其中充当 解释者 ,将遗传指令分解成更小的部分。这种酶将 DNA 转录成mRNA,mRNA 是遗传密码一小部分的特选拷贝,会被转移到 宽敞 得多的细胞质中的核糖体,在那里被翻译成蛋白,即生命的基本组成单位。
原核生物没有独特的细胞核和内膜 壁 ,转录和翻译同时进行,而且彼此距离很近,这使得 RNAP 和核糖体能够直接协调它们的功能并相互合作。
细菌是最容易理解的原核生物,由于其简单的遗传结构,为作者提供了理想的宿主来分析基因表达过程中核糖体-RNAP耦合的机制。
作者根据每个实验室的专长,采用了不同的技术和方法---Weixlbaumer团队采用Cryo-EM,而来自德国柏林的一个研究团队采用了细胞内交联质谱分析法来研究相关过程。Chauvier 和密歇根大学化学与生物物理学教授Nils Walter拥有生物物理学方面的专业知识,他们利用先进的单分子荧光显微镜分析了这种复合物结构的动力学。
Chauvier说, 为了追踪这种分子机器的工作速度,我们给它的两种成分分别贴上了不同颜色的标签。我们用一种荧光颜色标记新生 RNA,用另一种荧光颜色标记核糖体。这样我们就能在高倍显微镜下分别观察它们的动力学。
他们观察到,当核糖体蛋白 bS1 存在时,从 RNAP 出来的 mRNA 与核糖体小亚基(30S)结合的效率特别高,这有助于 mRNA 展开,为在核糖体内翻译做准备。
Webster 和 Weixlbaumer 的低温电镜结构指出了将 mRNA 运送到核糖体的另一种途径,即通过耦合转录因子 NusG 或其变体 RfaH 将 RNA 聚合酶拴住,NusG或RfaH 从 bS1 的另一侧将 mRNA 穿入核糖体的 mRNA 进入通道。
在成功地观察到建立 RNAP 和核糖体之间耦合的第一阶段后,作者期待着进一步合作,以找出这种复合物必须如何重新排列才能充分发挥功能。(100yiyao.com)
参考资料:
Michael W. Webster et al. . Science, 2024, doi:10.1126/science.ado8476.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:揭示小细胞肺癌劫持神经元突触从而加速生长背后的分子机制 (2025-09-12)
- Nat Commun:口腔微生物界的“超级英雄”!科学家揭示细胞外遗传元素Inocle的发现与意义 (2025-09-12)
- Trends Biotechnol.:武汉大学陈刚/余自力等团队提出FACTORY全自动 EV 分离平台,把 EV 分离从“小作坊”直接升级成“标准化工厂” (2025-09-12)
- EMBO Mol Med:罕见基因突变有望揭示肠道干细胞的再生奥秘 (2025-09-11)
- STTT:打断肿瘤的“狗腿”!科学家发现,抑制中性粒细胞的STAT3,会让中性粒细胞“改邪归正”,促进T细胞抗癌 (2025-09-11)
- Cell:IL-25诱导的记忆2型固有淋巴细胞,强化黏膜免疫 (2025-09-11)
- Nature Medicine:靶向休眠肿瘤细胞,预防乳腺癌复发 (2025-09-11)
- PLoS Biol:肠道真菌与人类健康——科学家揭秘基因与微生物的神秘联系! (2025-09-11)
- Nature重磅:“装甲型”CAR-T治疗实体瘤新突破,细胞因子精准“爆破”且全身毒性归零 (2025-09-11)
- 【9·10致敬全体教师】2025细胞外囊泡大会(厦门站)免费票速抢!! (2025-09-10)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















