Science:新研究成功破解细胞防止新生的蛋白质过早释放之谜 |
 |
来源:100医药网 2025-08-25 12:12
发现结果颠覆了公认的教科书解释:合适位置根本不存在水分子来断裂键合。相反,释放因子促使tRNA发生形变,充分释放其隐藏化学潜能——tRNA的一小部分会延伸并自行断裂键合,将成品蛋白质从核糖体释放。生物学的中心法则:所有生命体的遗传信息都存储在DNA中,DNA被转录为RNA,RNA再被翻译成蛋白质 这些蛋白质执行细胞内几乎所有基本功能。一种名为核糖体的微型细胞机器持续构建蛋白质,直到接收到停止信号,随后通过与水分子发生反应,将合成完毕的蛋白质释放到细胞中。
但科学家长期困惑于一个细节:如果仅需一个水分子就能释放成品蛋白质,为何这种情况不会意外发生?
如今,伊利诺伊大学芝加哥分校的研究人员揭示了这一过程背后的详细化学机制。这项发表于《科学》杂志的研究,不仅解答了生物学领域的长期谜题,更阐明了所有生命体执行蛋白质生产这一生命核心过程的具体方式。

从硬盘到3D打印机
DNA如同硬盘,以基因形式存储生物体的遗传信息。每个基因包含制造特定蛋白质的指令,而蛋白质控制着细胞的大部分功能 无论是肠道消化、血液输氧还是肌肉收缩。
但细胞无法直接使用这些指令。首先需要以信使RNA(mRNA)形式制作副本,随后核糖体读取mRNA,通过精确序列连接氨基酸来组装对应蛋白质。
"蛋白质制造过程对生命具有绝对基础性意义,"该研究通讯作者、伊利诺伊大学芝加哥分校文理学院生物科学教授Yury Polikanov表示。
在细胞内,核糖体与辅助蛋白读取mRNA的核苷酸"语言",并将其翻译成蛋白质的氨基酸"语言"。"核糖体如同细胞3D打印机,实际接收基因组指令并制造蛋白质,"Polikanov解释道。
当核糖体在mRNA中遇到称为终止密码子的特殊信号时,便停止"打印"新蛋白质。此时,一种名为释放因子的专用辅助分子进入核糖体,触发成品蛋白质从携带它的转移RNA(tRNA)分子上释放。
这一最终步骤涉及通过水解作用(与水分子的化学反应)打破成品蛋白质与tRNA之间的键合。"知道何时停止蛋白质链的 打印 与知道何时开始同样重要,"Polikanov强调,"该过程故障可能导致严重后果",例如产生有缺陷或危险的蛋白质。终止密码子突变可能引发囊性纤维化或杜氏肌等致命疾病。
全貌揭示
此前研究人员一直无法确切理解键裂解释放过程的机制:如果水解仅需水分子,为何键合不会因随机碰撞的水分子而自发断裂?
曾有推测认为释放因子携带水分子启动断裂过程。但由于该步骤发生过快,科学家难以捕捉观察。任何试图在试管中组装所有组分并在"打印"停止前冻糖体的尝试,都会导致蛋白质提前释放。
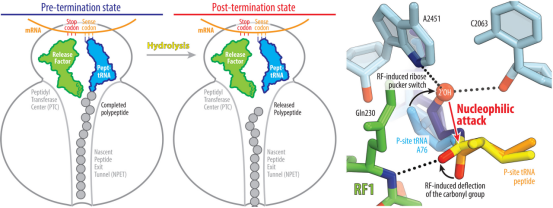
核糖体上肽释放的机制
幸运的是,Polikanov团队拥有独门技术。2022年,他们开发出能模拟tRNA-蛋白质键合但不会被水分子破坏的"不可水解"分子。利用这种不可水解模拟物,研究团队通过X射线晶体学方法以近原子分辨率捕获了蛋白质释放反应的详细快照。
发现结果颠覆了公认的教科书解释:合适位置根本不存在水分子来断裂键合。相反,释放因子促使tRNA发生形变,充分释放其隐藏化学潜能 tRNA的一小部分会延伸并自行断裂键合,将成品蛋白质从核糖体释放。
"它实际上是通过推动或踢击底物来自行促进水解,"Polikanov表示。这一发现解释了为何终止过程需要释放因子参与:这种微调控确保蛋白质不会提前释放,其长度严格受对应基因定义。
Polikanov指出,UIC研究人员揭示的蛋白质释放机制似乎在所有生命形式中通用 从细菌到人类。该发现同时凸显了细胞机器的精确性与精巧性。"我们揭示了最基础生物学过程的实际运作方式,"Polikanov总结道,"不仅是释放因子带来正确成分,它还重新定位现有部件使系统能自行完成任务。"(100yiyao.com)
参考文献:
Zijian Zhang et al, , Science (2025). DOI: 10.1126/science.adn2623.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature系列综述:西湖大学董晨院士系统总结CD8⁺T耗竭的调控因子 (2025-10-16)
- 由趋势观前沿:毕马威正式发布第三届生物科创领航50企业报告 (2025-10-15)
- 从“假基因”到“致病元凶”!Brain新研究:SSPOP基因复合杂合突变诱发儿童癫痫,多模型证实其功能与致病机制 (2025-10-15)
- Science:“吃不胖”的免疫学新解——T细胞胆固醇稳态是决定膳食脂肪吸收的关键 (2025-10-15)
- 迈威生物靶向 CDH17 ADC 创新药 7MW4911 临床试验申请获得 NMPA 批准 (2025-10-14)
- 西湖大学开发AI科学家,实现全自动科学发现,两周搞定人类科学家三年工作 (2025-10-14)
- Oncoscience:你的精子在“求救”?印度科学家发现,这些日常习惯正在偷走生育力! (2025-10-14)
- 腹痛便血反复?J Ethnopharmacol:“中医解法”被证实!芍药汤能精准激活肠干细胞,修复黏膜不反复 (2025-10-14)
- STTT:华西医院科学家发明可修复血脑屏障的纳米药物,可快速清除阿尔茨海默病毒蛋白、改善认知! (2025-10-14)
- Nature子刊:房颤竟是一种自身免疫疾病? (2025-10-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















