东南大学发表最新Cell子刊论文 |
 |
来源:生物世界 2025-09-01 09:40
该研究开发了一种药物-多肽偶联物递送系统,该系统利用胰腺癌中过表达的酶来触发细胞内纳米纤维的自组装。是一种高度致命的,总体 5 年生存率不足 10%。手术干预是胰腺癌唯一可能治愈的治疗方法,但其预后仍然不佳。此外,只有不到 20%的患者适合进行手术切除。因此,化疗(例如辅助化疗、新辅助化疗或全身化疗)在胰腺癌治疗中发挥着越来越重要的作用。
作用于细胞核的化疗药物,是治疗胰腺癌的高效药物,但清除作用以及的核孔尺寸较小,这两大障碍显著降低了这些药物或其纳米制剂的递送效率。
2025 年 8 月 22 日,东南大学梁高林教授团队在 Cell 子刊Cell Biomaterials上发表了题为:Intracellular nanofiber formation triggers nuclear fragmentation to enhance chemotherapeutic effect of camptothecin的研究论文。
该研究开发了一种药物-多肽偶联物递送系统,该系统利用胰腺癌中过表达的酶来触发细胞内纳米纤维的自组装,这些纳米纤维破坏了细胞核的完整性,使化疗药物药物喜树碱(CPT)积累量显著增加,同时避开了全身免疫系统的检测。
更重要的是,除了胰腺癌,这种策略还可应用于其他难以治疗的肿瘤,例如胶质母细胞瘤、三阴性,这些肿瘤的细胞核递送一直是个难题。此外,通过模块化替换酶响应基序和治疗有效载荷,该平台还能够将药物、基因编辑器或放射性核素直接递送至细胞核。

作用于细胞核的药物(例如吉西他滨、5-和喜树碱等),通过影响核酸生物合成、破坏 DNA 或干扰转录过程发挥抗肿瘤活性,仍是胰腺癌一线化疗中最常见的选择。然而,这些传统药物往往伴有严重的脱靶毒性,且众所周知的耐药性极大地限制了其应用。为了解决这些问题,研究人员开发了能够将化疗药物递送至肿瘤部位的纳米载体。然而,大多数已报道的纳米载体只能将这些治疗剂递送至癌细胞的细胞质,而非细胞核。由于核作用药物的疗效取决于其能否定位到细胞核内,因此,在肿瘤学领域,开发能够实现精确核靶向的给药系统已成为当务之急。
目前,已有几种策略被报道用于核内递送,包括被动扩散、主动核转运以及核膜开放。传统的被动扩散策略能让少量的小分子或纳米材料进入细胞核,但由于癌细胞核孔的尺寸较小(约 10 纳米),其效果不佳。或者,通过在药物分子或其纳米制剂上添加核定位信号(NLS)来促进其向细胞核内的运输。核定位信号(NLS)通常带有正电荷,以增强其与带负电荷的 DNA 的亲和力,从而使这些 NLS-药物偶联物更容易被单核吞噬细胞系统捕获。最近有研究提出了核膜开放策略,这种方法可以通过外源性刺激(例如热和光照射)破坏核膜的完整性,从而促进小分子药物或纳米药物进入细胞核。然而,这种策略的临床应用可能会受到外源性刺激生物相容性低或组织穿透深度有限的阻碍。
在这项新研究中,研究团队理性设计了一种药物-多肽偶联物 Asp-Thr-Lys-Thr-Gly-Pro-Ala-Lys(SA-CPT)-Phe-Phe-Nap(简称1-CPT-Nap)。该偶联物在成纤维细胞活化蛋白 (FAP )和羧酸酯酶的激活下,可释放喜树碱(CPT)并在细胞内形成Ala-Lys(SA)-Phe-Phe-Nap(简称2-Nap)纳米纤维。原位生成的 2-Nap 纳米纤维通过诱导细胞周期 G2/M 期阻滞并引发核碎裂,促进更多喜树碱进入细胞核。
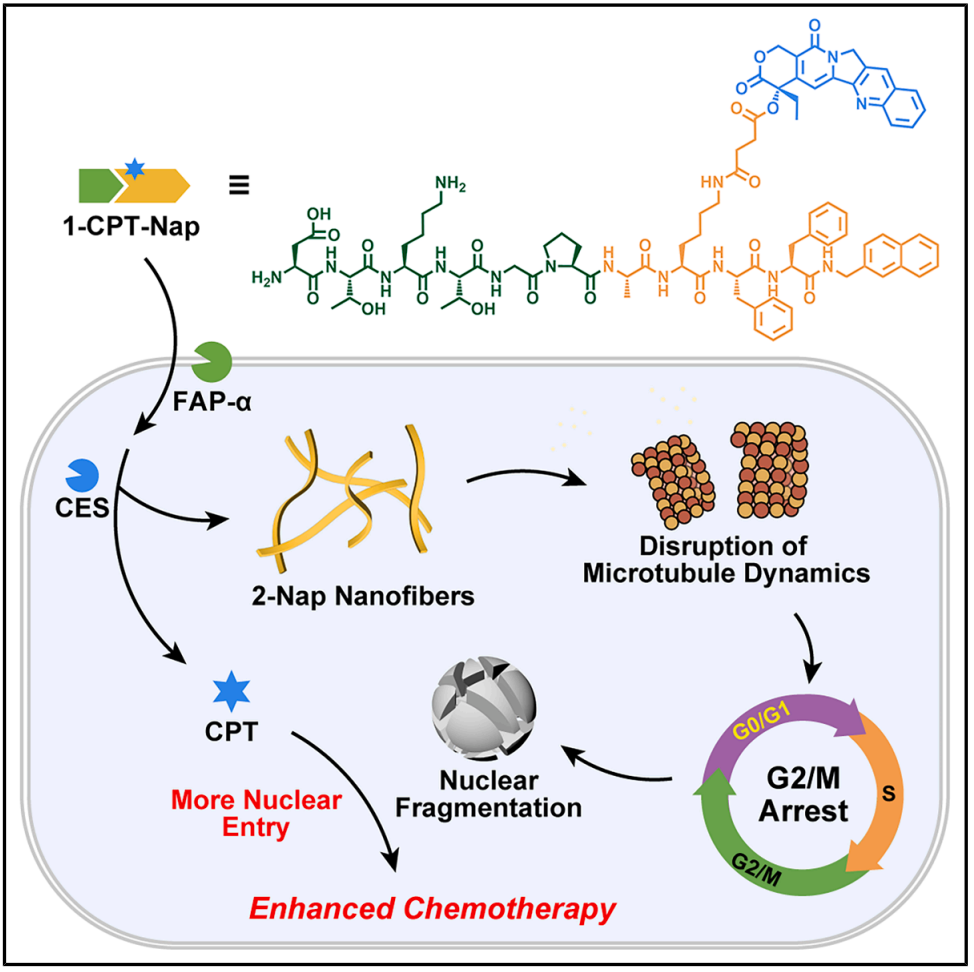
细胞实验表明,2-Nap 纳米纤维诱导的核碎裂使喜树碱入核效率提升了 1.8 倍。动物实验显示,1-CPT-Nap 对胰腺癌小鼠模型的抗肿瘤疗效是游离喜树碱的 1.5 倍。这种基于细胞内酶响应性纳米纤维生成的新策略,为增强化疗药物的细胞核内递送提供了创新解决方案。研究团队表示,预期 1-CPT-Nap 未来有望进入临床试验阶段。
这项研究通过利用肿瘤特异性生物化学作为药物释放的触发因素,实现了超分子材料设计与临床肿瘤学之间的衔接 这是迈向个性化、精准纳米医学的关键进展。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature系列综述:西湖大学董晨院士系统总结CD8⁺T耗竭的调控因子 (2025-10-16)
- 由趋势观前沿:毕马威正式发布第三届生物科创领航50企业报告 (2025-10-15)
- 从“假基因”到“致病元凶”!Brain新研究:SSPOP基因复合杂合突变诱发儿童癫痫,多模型证实其功能与致病机制 (2025-10-15)
- Science:“吃不胖”的免疫学新解——T细胞胆固醇稳态是决定膳食脂肪吸收的关键 (2025-10-15)
- 迈威生物靶向 CDH17 ADC 创新药 7MW4911 临床试验申请获得 NMPA 批准 (2025-10-14)
- 西湖大学开发AI科学家,实现全自动科学发现,两周搞定人类科学家三年工作 (2025-10-14)
- Oncoscience:你的精子在“求救”?印度科学家发现,这些日常习惯正在偷走生育力! (2025-10-14)
- 腹痛便血反复?J Ethnopharmacol:“中医解法”被证实!芍药汤能精准激活肠干细胞,修复黏膜不反复 (2025-10-14)
- STTT:华西医院科学家发明可修复血脑屏障的纳米药物,可快速清除阿尔茨海默病毒蛋白、改善认知! (2025-10-14)
- Nature子刊:房颤竟是一种自身免疫疾病? (2025-10-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















