Nature Materials:程强/魏妥团队开发新型LNP,将mRNA精准送达肺/肝/脾/胸腺/骨骼,实现器官精准先导编辑 |
 |
Nature Materials:程强/魏妥团队开发新型LNP,将mRNA精准送达肺/肝/脾/胸腺/骨骼,实现器官精准先导编辑
来源:生物世界 2025-09-03 09:59
PILOT 平台提供了一种可预测的方法学用于理性设计器官/组织特异性靶向的脂质纳米颗粒(LNP)有助于改进基于 mRNA 的基因编辑疗法的开发。随着mRNA及其递送载体脂质纳米颗粒(LNP)的发展,将基因药物递送至肝脏已在临床上取得显著成功,LNP 具有高效性、生物相容性以及可重复给药的优点,有望改变当前的疾病治疗格局。然而,由于全身系统性给药后 LNP 倾向于在肝脏中积聚,难以实现器官/组织及细胞特异性递送,这也成为了基于 LNP 的基因治疗的广泛应用的主要瓶颈。
2025 年 9 月 1 日,北京大学未来技术学院程强团队与中国科学院动物研究所魏妥团队合作,在Nature Materials期刊发表了题为:Tissue-specific mRNA delivery and prime editing with peptide ionizable lipid nanoparticles的研究论文【1】。
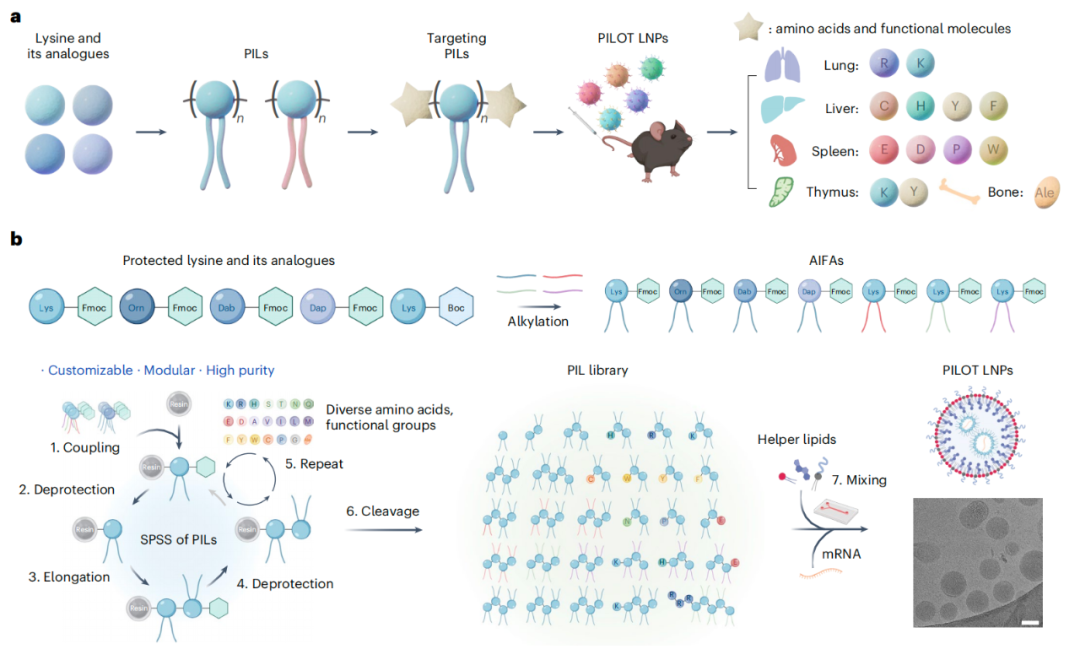
该研究将两大类生物材料 多肽(Peptide)和可电离脂质(Ionizable Lipid)相结合,创造出新型的多肽可电离脂质(Peptide-Ionizable Lipid,PIL)材料,进而建立了一种多肽可电离脂质驱动的器官靶向平台 PILOT,基于该平台的 LNP 能够实现器官特异性和器官可调控的 mRNA 递包括特异性靶向肺、肝脏、脾脏、胸腺和骨骼。特别是,向肝脏递送 mRNA 的效果和安全性方面与美国 批准的制剂相当。此外,该研究开发的肝脏 PILOT LNP和肺PILOT LNP,能够高效共递送先导编辑组分(PEmax mRNA 和 epegRNA),分别实现了对肝脏和肺部的高效先导编辑。
PILOT 平台提供了一种可预测的方法学用于理性设计器官/组织特异性靶向的脂质纳米颗粒(LNP)有助于改进基于 mRNA 的基因编辑疗法的开发。

为了满足肝脏以外器官/组织的治疗需求,研究人员已投入大量精力对 mRNA-LNP 进行工程改造,以使其能够到达肝脏以外的目标,包括使用配体偶联、组分优化、新型可电离脂质开发,以及直接向眼球等器官注射 LNP。
可电离脂质作为 LNP 配方中的关键组分,决定了纳米颗粒的效力和器官选择性,并且已被广泛研究用于靶向 mRNA 递送。通过组合化学对脂质结构进行定制,研究人员发现了发现了能够借助高通量筛选、条形码技术或机器学习辅助评估不同器官递送能力的可电离脂质。尽管如此,有限的化学反应与组合合成和高通量筛选过程相兼容,而脂质的化学结构仍需要更大的结构灵活性和多样性。此外,由于缺乏设计标准,要可预测且理性设计用于向肝外组织递送的可电离脂质,仍相当具有挑战性。
多肽(Peptide)是由酰胺键连接的短的、序列确定的氨基酸链。鉴于氨基酸含有多种具有不同物理化学性质和功能的侧链,多肽具有很大的设计灵活性。研究团队探索了将两大类生物材料 多肽(Peptide)和可电离脂质(Ionizable Lipid)相结合,进而创造一种新型的多肽可电离脂质(PIL)材料,这种新型材料继承了其来源双方的结构特征,从而拓展了可电离脂质的化学设计空间。
传统的脂质组合合成是通过液相反应进行的,而这需要大量的反应后处理和纯化工作,不利于生产 PIL。固相支持合成(SPSS)提供了一种新思路,与液相合成相比,SPSS 系统具有模块化、可定制化、精度高以及更简单、更快等优点。在 SPSS 过程中,氨基酸构件依次在固体支持物上组装,多余的反应物很容易被冲洗掉,无需对反应中间体进行繁琐的纯化处理。此外,用于 SPSS 的构建模块的数量和功能极大地拓展了脂质设计的维度。因此,研究团队目标是开发一种 SPSS 方法,以实现具有高度结构多样性的 PIL 的模块化合成,并且要了解设计用于器官靶向 mRNA 递送的可电离脂质是否有价值的结构标准。
在这项最新研究中,研究团队开发了一个多肽可电离脂质(PIL)驱动的器官靶向平台 PILOT,该平台可实现器官特异性和器官可调控的 mRNA 递送。
研究团队通过固相支持合成(SPSS)方法模块化合成了120 多种结构多样的多肽可电离脂质(PIL),其由天然氨基酸(或其他功能性模块)与人工烷基化可电离 Fmoc 保护氨基酸(AIFA)组成。
体内初步筛选发现,含赖氨酸(lysine)或 2,4-二氨基丁酸(Dab),且饱和烷基链长度为 12、AIFA 数值为 3-5 的 PIL,能够实现最优的蛋白质表达。其中,a12Dab4 PIL 向肝脏中递送的 mRNA 表达水平显著高于美国 FDA 批准的 LNP 中使用的可电离脂质ALC-0315,且在高 mRNA 剂量下表现出相当的安全性。
构效关系(SAR)和构选关系(SSR)分析表明,烷基链和类型、AIFA 模块数量、侧链长度以及 N 端或 C 端的修饰,对 PIL 的效力和器官选择性具有调控作用。重要的是,研究团队发现了一种可扩展的氨基酸修饰策略,用于设计 PIL,以实现通过 LNP 进行可调控且可预测的 mRNA 递送。
具体来说
赖氨酸/精氨酸修饰 实现 mRNA 的肺靶向递送;
半胱氨酸/组氨酸/酪氨酸/苯丙氨酸修饰 实现mRNA 的肝靶向递送;
谷氨酸/天冬氨酸/脯氨酸/色氨酸修饰及 N -乙酰化赖氨酸/精氨酸修饰 实现mRNA 的脾脏特异性递送;
赖氨酸-酪氨酸二肽的加入 显著提升 mRNA 的胸腺靶向递送;
阿仑膦酸(Ale)的加入 显著提升mRNA 的骨骼靶向递送。
利用 PILOT 平台开发的PILOT-LNP 介导了有效的 Cre mRNA 递送,并在特定靶组织中实现了基因编辑。研究团队使用肝脏 PILOT-LNP 和肺 PILOT-LNP 分别一体化 一体化 共递送先导编辑组分(PEmax mRNA 和 epegRNA),分别在肝脏(编辑效率为 13.1%)和肺部(编辑效率为 7.4%)实现了有效且特异性的先导编辑。
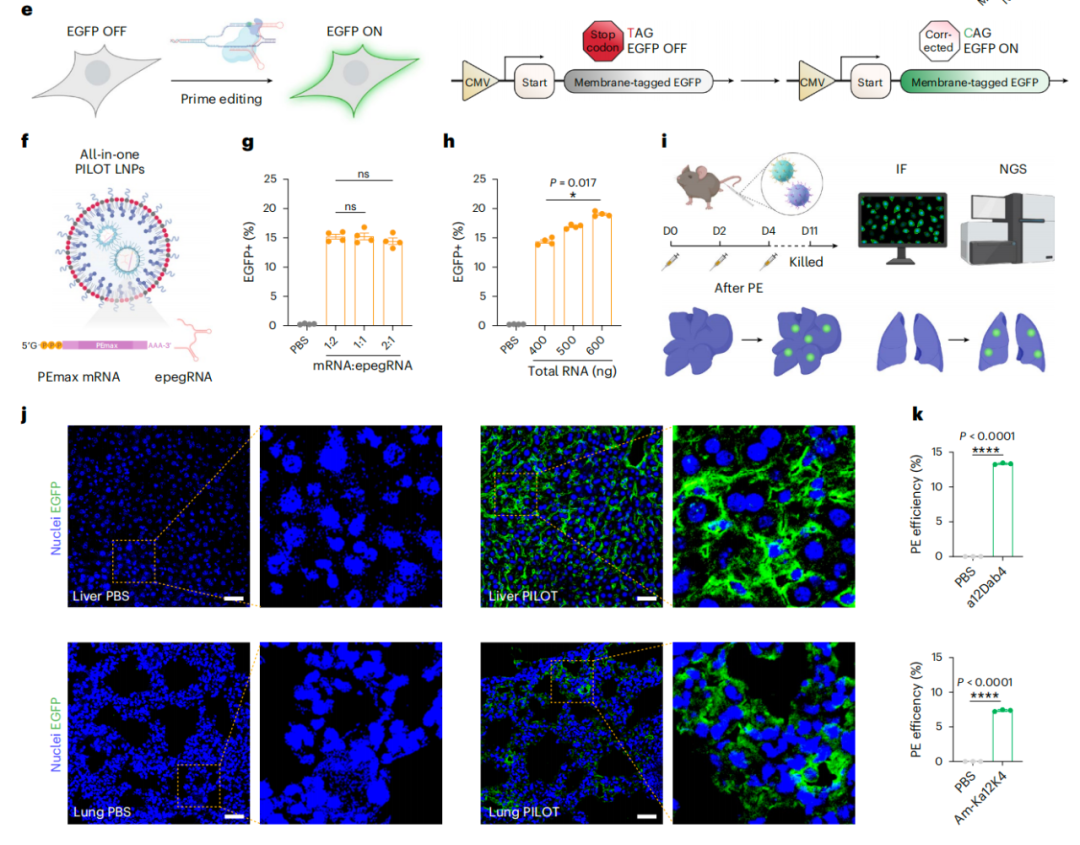
总的来说,该研究提出的通用设计策略为开发器官靶向的可电离脂质提供了新的结构标准,研究中展示的 PILOT LNP 平台在器官特异性先导编辑疗法开发中具有巨大潜力。
程强课题组博士后招聘,联系方式:qiangcheng@pku.edu.cn,招聘详情见今天最后一条推送。
值得一提的是,Nature Materials期刊同期背靠背发表了来自清华大学邵玥副教授、高华健院士团队的题为:Peptide codes for organ-selective mRNA delivery的研究论文【2】。
该研究开发了一种多肽编码的器官选择性靶向(peptide-encoded organ-selective targeting,POST)方法,通过利用特定氨基酸序列对 LNP 进行表面工程化模块调控,实现全身给药后将 mRNA 向肝外器官的高效特异性递送。
POST 系统的器官选择性靶向源于多肽修饰 LNP 表面形成的特异性蛋白冠,其核心机制是通过多肽序列与血浆蛋白结合亲和力的力学优化实现靶向调控。该研究显著拓宽了器官靶向递送的适用范围与功能多样性,为精准递送系统的理性设计提供了可编程框架。

1. https://www.nature.com/articles/s41563-025-02320-9
2. https://www.nature.com/articles/s41563-025-02331-6
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 加科思药业就非肿瘤资产与海松资本达成战略交易 聚焦核心创新管线 (2025-10-16)
- Cell:遗传变异可导致复杂疾病的不同临床特征 (2025-10-16)
- 国度医保局曝光5起骗取生养保险基金典型案例 (2025-10-16)
- 天气转凉这些沾染病多发!防护攻略看这里 (2025-10-16)
- AD:肠炎阻碍大脑“排毒”!研究发现,肠道炎症通过扰乱昼夜节律,损害大脑类淋巴系统排污能力,为神经退行性疾病的发生埋下伏笔 (2025-10-16)
- 解决胰岛素百年困境!David Baker团队从头设计出更安全有效的“AI胰岛素”,开启糖尿病治疗新时代 (2025-10-16)
- Cell Stem Cell:刘光慧团队等首次证实,维生素C可延缓灵长类卵巢衰老 (2025-10-16)
- 《自然·遗传学》:难怪食管癌那么凶狠!中国科学家首次发现一种周细胞,不仅能促进食管癌转移,还能打造免疫抑制微环境 (2025-10-16)
- 《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈 (2025-10-15)
- 闻一口就知道爱不爱?《细胞》研究揭脑内机制:侧角区神经元当“裁判”,两套逻辑判香臭 (2025-10-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















