揪出阿尔茨海默病的“小刺客”!最新研究:血液细胞外囊泡带 C1q 过血脑屏障,促神经元产 Aβ 加速病情 |
 |
揪出阿尔茨海默病的“小刺客”!最新研究:血液细胞外囊泡带 C1q 过血脑屏障,促神经元产 Aβ 加速病情
来源:100医药网 2025-09-04 09:00
这项研究无疑为 AD 领域点亮了新的希望,让我们离 “留住记忆” 又近了一步!
妈,你上周刚办的银行卡怎么又找不到了? 、 爸,我们昨天刚聊过的事,你怎么一点印象都没有? 生活中,不少人都会经历家人记忆力衰退的场景,起初总以为是 年龄大了的正常现象 ,可随着症状加重,才惊觉可能与(AD)有关。
作为全球最常见的痴呆类型,AD 堪称 记忆的慢性杀手 ,它不仅会逐步剥夺患者的认知能力,晚期还会让患者失去生活自理能力,给家庭带来沉重负担。尽管目前已有阿杜卡单抗、莱卡单抗等靶向 A 的药物获批,但它们仅能暂时缓解症状,无法阻止病情进展。这背后的关键问题在于,AD 的病理机制远比 大脑堆积 A 复杂 其中,细胞外囊泡(EVs) 与补体 C1q 的角色一直充满争议。
此前研究中,有人认为循环 EVs 会促进 A 生成,也有人称其能帮助清除 A ;补体 C1q 同样如此,既有研究说它能保护神经,也有研究指出它会破坏突触。而近期发表在《Journal of Neuroinflammation》的研究,终于厘清了这两个 争议角色 的关联:AD 模型小鼠血液中的细胞外囊泡(APPEVs) ,会携带补体 C1q 跨越血脑屏障,向神经元传递 异常指令 ,促使 A 大量生成。这一发现不仅解开了此前的研究争议,更让细胞外囊泡成为早期 AD 与治疗的新靶点,为对抗 AD 提供了全新方向。

实验意义与目的
此前研究的核心困惑集中在两点:一是循环细胞外囊泡在 AD 中究竟是 保护者 还是 破坏者 ?二是补体 C1q 作为系统蛋白,为何会与 A 的生成产生关联?因此,本研究的核心目的明确:验证 AD 模型小鼠的循环细胞外囊泡(APPEVs)是否通过携带特定蛋白(如补体 C1q),激活神经元内的信号通路,最终促进 A 生成与斑块聚集;若成立,则进一步解析其具体作用机制。
实验 阵容
实验对象:
动物模型:6 月龄雄性 C57BL/6 野生型(WT)小鼠,及同月龄 APP/PS1 转基因 AD 小鼠(该模型会模拟 AD 病理,脑内会出现 A 斑块堆积);14 周龄 APP/PS1 小鼠(用于早期 AD 干预实验,此时尚未形成大量 A 斑块)。
细胞模型:从 WT 与 APP/PS1 小鼠胚胎(E16-17)中提取的原代皮层神经元,用于体外机制验证。
研究整体分为 提取鉴定细胞外囊泡 、 体外验证机制 、 体内验证效果 三大环节:从 WT 小鼠和 APP/PS1 AD 模型小鼠血浆中,经多步离心与色谱分离,提取出 WTEVs 和 APPEVs,再通过 Western blot、纳米流式细胞仪、透射电镜确认其纯度与身份;体外将原代神经元分四组处理,用多种技术验证 APPEVs 对 A 生成的影响及机制;体内通过给小鼠注射荧光 EV 或不同试剂,观察 EV 跨血脑屏障能力及对脑内 BACE1、A 斑块等的作用。
细胞外囊泡的 作案细节 全揭秘
1. AD 小鼠的细胞外囊泡:数量更多,且携带 有害货物 C1q
研究首先确认 APP/PS1 小鼠的 AD 模型有效性:免疫荧光显示,6 月龄 APP/PS1 小鼠海马区出现明显 A 斑块,而 WT 小鼠无此现象,说明模型符合实验要求。
随后对提取的细胞外囊泡分析发现:
数量差异:纳米流式细胞仪结果显示,WTEVs 与 APPEVs 的平均粒径相近(约100nm),但 APPEVs 的浓度显著高于 WTEVs,意味着AD 小鼠血液中的细胞外囊泡数量更多,相当于 异常快递 的总量增加。
内容物差异:通过 LC-MS/MS 蛋白质组学分析,APPEVs 中存在 24 种显著上调的蛋白,其中补体 C1q 的两个亚基(C1qa、C1qb)同时富集于 神经退行性疾病通路 与 免疫系统通路 ,是两类通路的交集蛋白。ELISA 进一步验证:APPEVs 中的 C1q 浓度显著高于 WTEVs,而血浆中游离的 C1q(EV-free 组分)在两组小鼠中无差异,说明C1q 并非游离存在,而是被细胞外囊泡 打包运输 ,这也解释了为何此前研究中 C1q 的作用会出现争议 其功能与 运输载体(EV) 密切相关。
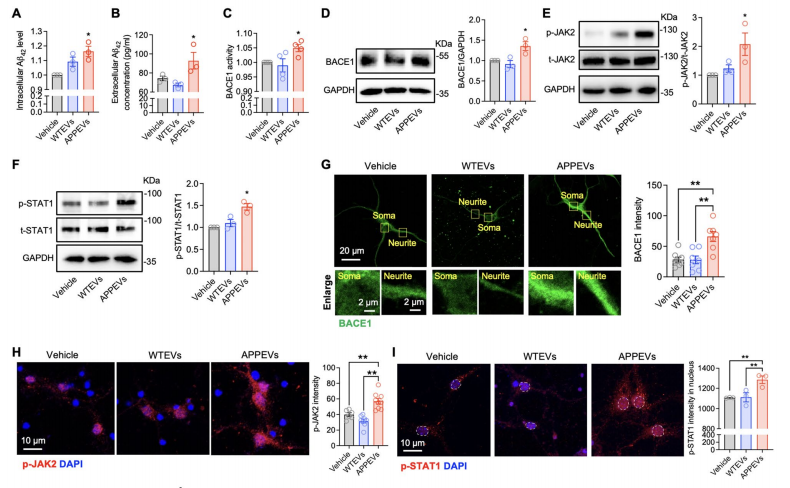
图:APPEV通过JAK2- -BACE1信号通路诱导神经元A-STAT42的产生
2. APPEVs 通过激活 JAK2-STAT1 通路,促进神经元产 A
体外实验中,APPEVs 对神经元的影响十分明确:
A 42大量生成:ELISA 结果显示,与对照组和 WTEVs 组相比,APPEVs 处理后,原代神经元内与培养液中的 A 42浓度均显著升高。A 42是 AD 中毒性最强的 A 亚型,其增多直接意味着神经元的病理损伤风险上升。
BACE1 活性与表达上调:BACE1 是 APP 切割生成 A 的关键酶( - 分泌酶),荧光试剂盒检测发现,APPEVs 组的 BACE1 活性显著高于其他组;Western blot 结果也显示,APPEVs 组的 BACE1 蛋白表达量更高,说明 APPEVs 通过提升 产毒工具 BACE1 的水平,促进 A 生成。
JAK2-STAT1 通路被激活:Western blot 显示,APPEVs 处理后,神经元内 p-JAK2(JAK2 激活形式)与 p-STAT1(STAT1 激活形式)的水平显著升高,而总 JAK2、总 STAT1 无明显变化;免疫荧光进一步观察到,p-STAT1 向细胞核内转移,而细胞核分离实验也确认 APPEVs 组的核内 p-STAT1 增多。更关键的是,加入 JAK2 抑制剂 XL019 或 STAT1 抑制剂氟达拉滨后,APPEVs 诱导的 BACE1 上调被完全抑制,说明APPEVs 是通过激活 JAK2-STAT1 通路,调控 BACE1 表达,进而促进 A 生成 这一通路是 APPEVs 发挥作用的 核心指令链 。
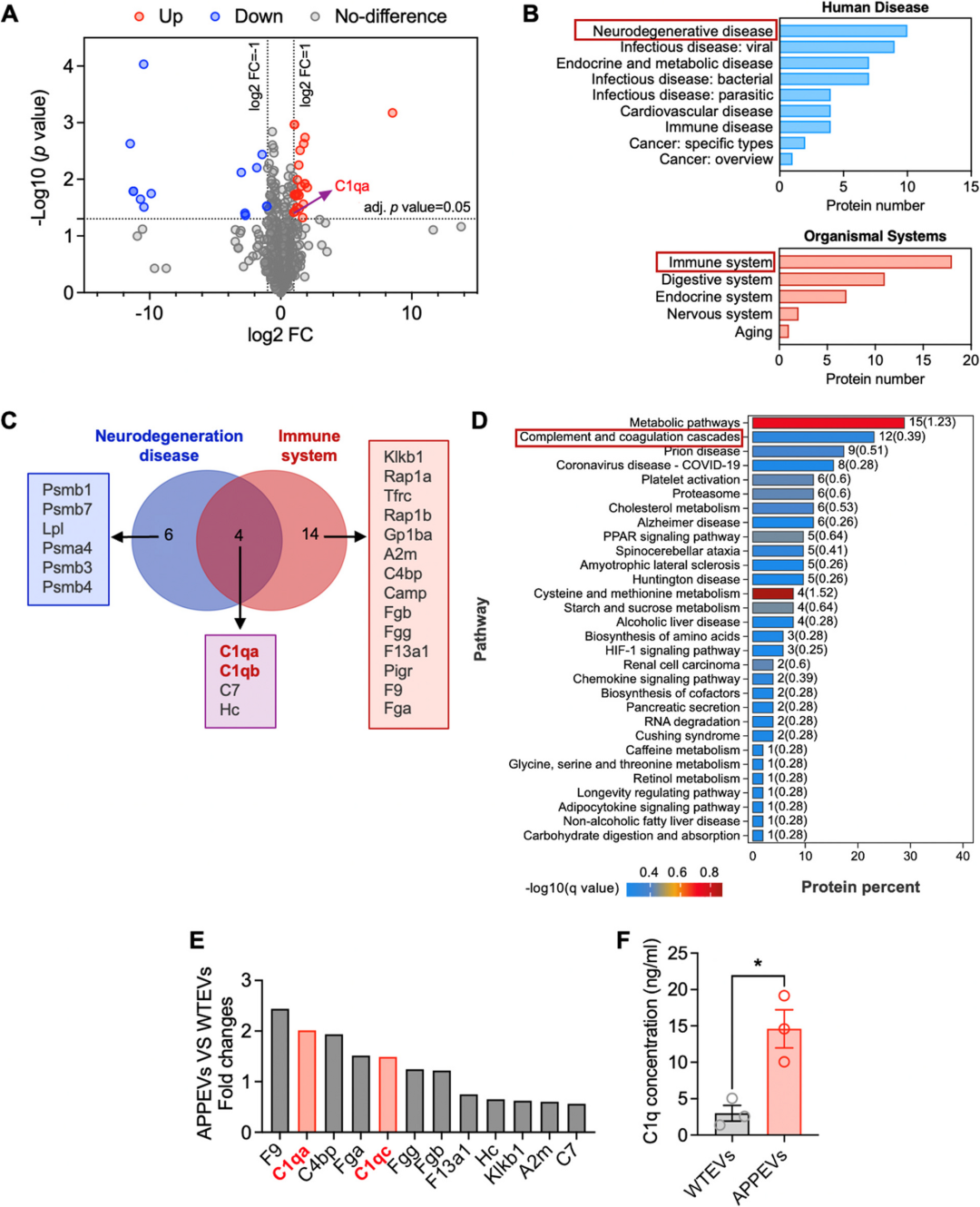
图:蛋白质组学分析表明,APPEV含有更多的C1q补体
3. C1q 是 APPEVs 中的 关键帮凶 ,缺失则无法促 A
为验证 APPEVs 中 C1q 的作用,研究加入了 C1q 抑制剂:
结果显示,C1q 抑制剂处理后,APPEVs 诱导的神经元内、外 A 42 升高被完全阻断;BACE1 的活性与蛋白表达也恢复至对照组水平;同时,p-JAK2 与 p-STAT1 的水平显著下降,p-STAT1 的核转移也被抑制。
此外,免疫荧光观察 APP 与 BACE1 在脂质筏(GM1 标记)的定位发现,APPEVs 会促进 APP 与 BACE1 在脂质筏共定位(利于 APP 切割),而加入 C1q 抑制剂后,这种共定位消失。且 LDH 实验显示,C1q 抑制剂本身不影响神经元存活,排除了 抑制剂毒性干扰结果 的可能。这表明,细胞外囊泡携带的 C1q 是激活 JAK2-STAT1 通路、促进 A 生成的关键,没有 C1q,APPEVs 就无法发挥有害作用。
4. APPEVs 可跨越血脑屏障,在体内促进 A 斑块形成
体内实验进一步证实了 APPEVs 的 破坏力 :
跨越血脑屏障且不破坏屏障:给 WT 小鼠尾荧光标记的 WTEVs 或 APPEVs,3 小时后大脑中可检测到明显荧光,而游离荧光染料(PBS-DiR)组无荧光,说明细胞外囊泡可跨越血脑屏障;同时,免疫荧光检测内皮紧密连接蛋白 CLDN1 与 JAM-A 发现,WTEVs 与 APPEVs 组的蛋白表达与对照组无差异,意味着EV 跨越血脑屏障时不会破坏屏障完整性,是 悄悄偷渡 进入大脑。
体内促进 A 斑块形成:对 14 周龄 APP/PS1 小鼠的干预实验显示,20 周龄时,APPEVs 组的神经元 BACE1 表达显著高于对照组与 WTEVs 组,而 APPEVs+C1q 抑制剂 组的 BACE1 表达恢复正常;同时,APPEVs 组海马区的 A 斑块数量更多、面积更大,C1q 抑制剂则完全阻断了这一效果。RT-qPCR 结果还显示,各组小鼠脑内的炎症因子(IL-6、IL-12b、TNF- 、IFN- )与内源性 C1q(C1qa)mRNA 水平无差异,说明APPEVs 是通过自身携带的 C1q 发挥作用,不会引发额外神经炎症,也不会诱导大脑自身合成 C1q,结果更具特异性。
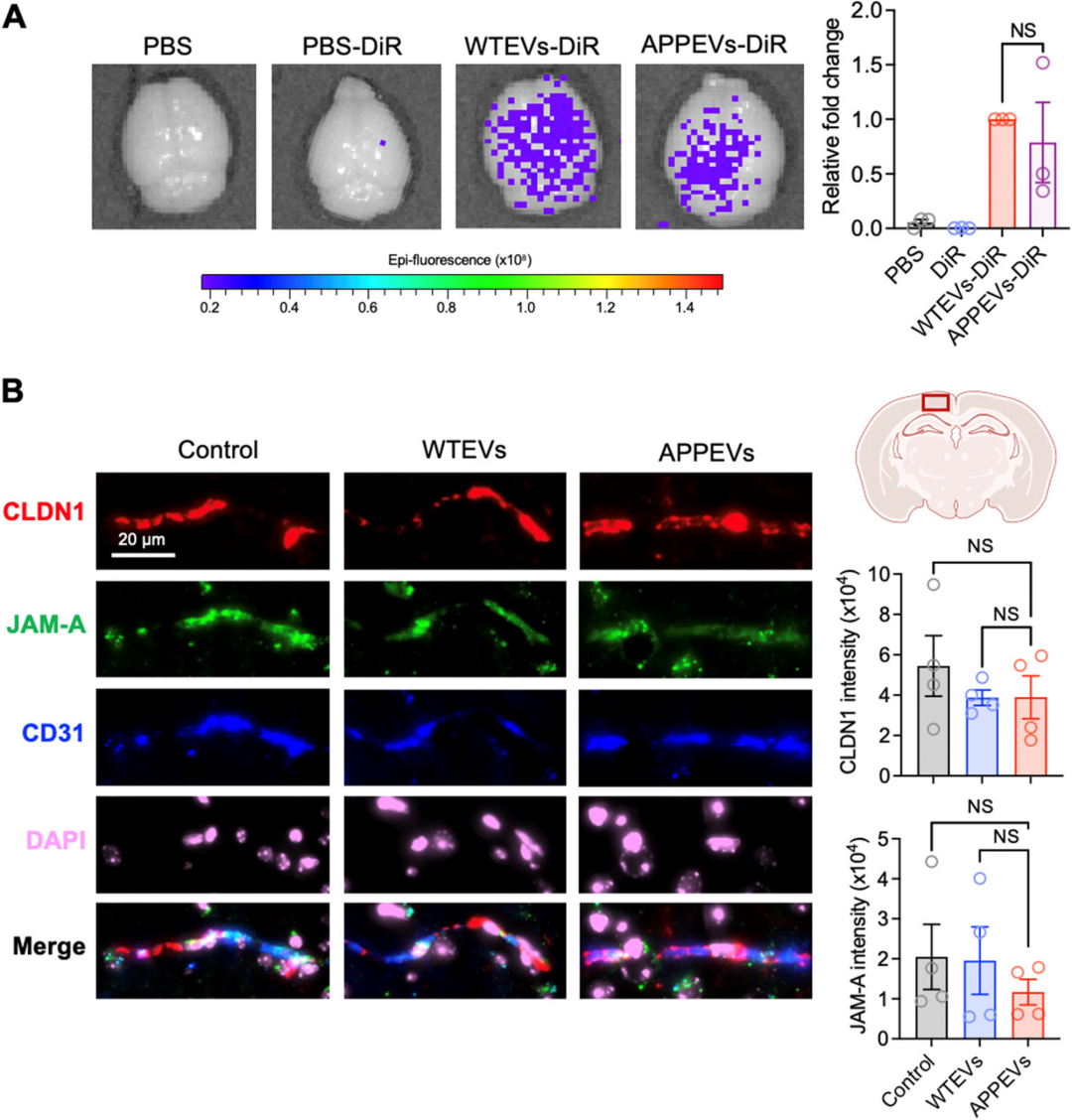
图:血浆EVS能穿透脑组织而不破坏血脑屏障
为何细胞外囊泡与 C1q 的作用此前 正反不一 ?
此前研究中,细胞外囊泡与 C1q 的作用之所以存在争议,核心原因在于 载体与环境差异 :正常状态下,WT 小鼠的细胞外囊泡(WTEVs) 不携带 C1q,可能通过其他 cargo 帮助清除 A ;而 AD 状态下,APPEVs 携带 C1q,定向作用于神经元,激活有害通路。
C1q 的争议也同理:游离的 C1q 可能参与 A 清除或突触保护,但若被细胞外囊泡 投递 到神经元,就会成为 有害信号 ,激活 JAK2-STAT1 通路促 A 生成。这就像 同一包裹,送对地方是帮助,送错地方是麻烦 ,而细胞外囊泡正是决定 C1q 送达地址 的关键载体。
小结
这篇研究用清晰的实验,揭露了细胞外囊泡在 AD 中的 作案逻辑 :AD 小鼠血液中的 APPEVs,携带补体 C1q 跨越血脑屏障,进入大脑后激活神经元的 JAK2-STAT1 通路,促使 BACE1 表达升高,进而加速 APP 的 切割,生成更多 A 42,最终导致 A 斑块堆积 整个过程就像 有害快递 精准投递 坏包裹 ,触发大脑内的 产毒流水线 。
这一发现的价值不仅在于解开了此前的研究争议,更给 AD 防治带来两大新方向:一是诊断层面,未来或许只需检测血液中细胞外囊泡的 C1q 水平,就能早期发现 AD 迹象,避免 等出现记忆问题才就诊 的被动局面;二是治疗层面,可通过 拦截携带 C1q 的 APPEVs 或 阻断 JAK2-STAT1 通路 ,从源头减少 A 生成,比现有 清理已形成的 A 策略更具前瞻性。总之,这项研究无疑为 AD 领域点亮了新的希望,让我们离 留住记忆 又近了一步。
参考文献:
Yu Y, Xiao W, Ma Z, Yi X, Zhong T, Li Z. Circulatory extracellular vesicles transport complement C1q for promoting neuronal amyloid- production in Alzheimer s disease. J Neuroinflammation. 2025 Aug 29;22(1):209. doi: 10.1186/s12974-025-03528-x. PMID: 40883774; PMCID: PMC12395740.
医药网新闻
- 相关报道
-
- Nature系列综述:西湖大学董晨院士系统总结CD8⁺T耗竭的调控因子 (2025-10-16)
- 由趋势观前沿:毕马威正式发布第三届生物科创领航50企业报告 (2025-10-15)
- 从“假基因”到“致病元凶”!Brain新研究:SSPOP基因复合杂合突变诱发儿童癫痫,多模型证实其功能与致病机制 (2025-10-15)
- Science:“吃不胖”的免疫学新解——T细胞胆固醇稳态是决定膳食脂肪吸收的关键 (2025-10-15)
- 迈威生物靶向 CDH17 ADC 创新药 7MW4911 临床试验申请获得 NMPA 批准 (2025-10-14)
- 西湖大学开发AI科学家,实现全自动科学发现,两周搞定人类科学家三年工作 (2025-10-14)
- Oncoscience:你的精子在“求救”?印度科学家发现,这些日常习惯正在偷走生育力! (2025-10-14)
- 腹痛便血反复?J Ethnopharmacol:“中医解法”被证实!芍药汤能精准激活肠干细胞,修复黏膜不反复 (2025-10-14)
- STTT:华西医院科学家发明可修复血脑屏障的纳米药物,可快速清除阿尔茨海默病毒蛋白、改善认知! (2025-10-14)
- Nature子刊:房颤竟是一种自身免疫疾病? (2025-10-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















