Cell系列综述:复旦大学舒易来团队等系统总结耳聋治疗的范式转变——临床基因治疗恢复听力 |
 |
来源:生物世界 2025-09-25 09:58
DFNB9 基因治疗实现成功的临床转化,为其他类型HHL的基因治疗药物开发提供了关键经验与可复制的路线蓝图。近日,复旦大学附属眼耳鼻喉科医院耳鼻喉科、耳鼻喉科研究院舒易来、李华伟,哈佛医学院耳鼻咽喉头颈外科陈正一和加州大学欧文分校听力研究中心曾凡钢合作(共同一作为复旦大学附属眼耳鼻喉科医院耳鼻喉科、耳鼻喉科研究院的韩双、陈紫婷和王大奇)在Cell Press旗下综述期刊Trends In Molecular Medicine上发表了题为:Clinical gene therapy restores hearing: a paradigm shift的综述论文。

亮点
以腺相关病毒(AAV)为载体的基因治疗策略,在动物模型中已被证实对20多种基因突变引起的遗传性耳聋有效。
2022 年,复旦大学附属眼耳鼻喉科医院率先完成临床试验注册,并在中国上海成功实施了全球首例遗传性耳聋基因治疗,成为先天性耳聋领域首次基因治疗临床实践。2023-2025 年期间,全球另有 7 项针对OTOF基因突变所致遗传性耳聋的基因治疗临床试验在 8 个国家注册。截止目前,5 项临床试验已报道通过双 AAV 递送策略成功恢复受试者听力,为遗传性耳聋的治疗开创了具有变革意义的临床框架。
临床试验是将创新治疗转化为临床实践的关键环节。该过程需要严谨的方案设计、开展安全性和有效性评估,并根据新出现的数据进行动态调整。
为推动遗传性耳聋基因治疗的持续优化,目前研究正针对手术给药方式、患者筛选标准以及标准化流程等挑战展开探索。
摘要
近期,针对OTOF基因突变所致常染色体隐性耳聋 9 型(autosomal recessive deafness 9,DFNB9)的基因治疗取得突破性成果,为遗传性听力损失(hereditary hearing loss,HHL)的治疗带来革命性的范式转变。迄今,DFNB9基因治疗的 8 项临床试验已在 8 个国家的 51 个中心注册,推动听觉医学基因治疗的快速发展。这些开创性的研究构建了 HHL 基因治疗临床转化的框架。该综述以OTOF基因治疗临床试验的最新进展为基点,重点讨论内耳给药途径、临床试验设计、药物安全评估与听觉恢复结局等关键转化要素。提出未来治疗策略优化的主要挑战,包括内耳的精细操作、受试者纳入标准的细化及结局指标的标准化。
开启遗传性耳聋基因治疗新时代
先天性耳聋患者约 2600 万,其中高达 60% 与遗传因素相关。超过200个基因与遗传性听力损失相关,但目前尚无临床获批治疗药物。基因治疗,作为一种基于病因学的治疗方式,旨在修复受损的听觉通路,使患者获得自然生理性听觉。近年来,HHL 的基础研究以及腺相关病毒(adeno-associated virus,AAV)介导的基因治疗取得重大进展。特别值得关注的是,OTOF基因编码的耳畸蛋白(otoferlin)作为带状突触囊泡膜融合所必需的钙离子感应蛋白,参与突触小泡的胞吐与补充。其致病突变引发 DFNB9,是婴幼儿听神经病主要病因之一(41%),占 HHL 的 2 8%。DFNB9 的典型临床表现为双侧重度至极重度甚至完全听力损失。当前 DFNB9 是唯一进入临床试验阶段的 HHL 类型(图1)。
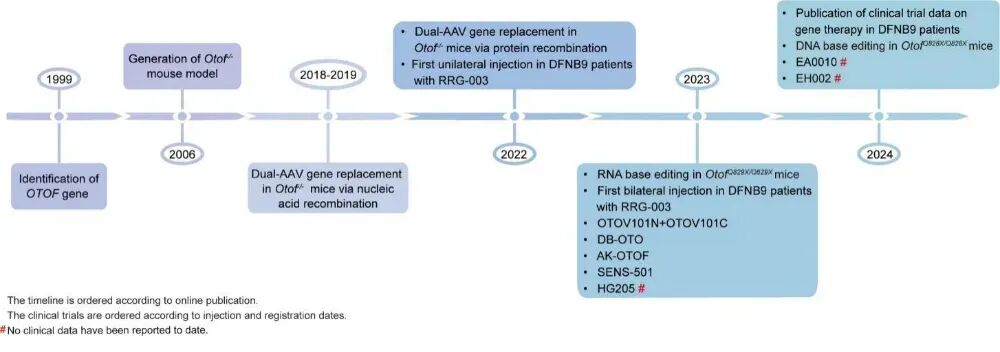 图1. OTOF 基因相关的里程碑事件
图1. OTOF 基因相关的里程碑事件
1999年,确定OTOF基因突变导致常染色体隐性聋9型(DFNB9)。2006年,构建Otof-/-小鼠模型。2018 2019年,双AAV核酸水平重组挽救Otof-/-小鼠听力。2022年,双AAV蛋白水平重组恢复Otof-/-小鼠听力。全球首例DFNB9基因治疗病例完成(药物RRG-003单侧给药),启动HHL 临床试验。2023年,全球首例双侧内耳注射(RRG-003双侧给药)。2023 2024年,药物OTOV101N+OTOV101C、DB-OTO、AK-OTOF、SENS-501进入临床试验;药物HG205、EA0010、EH002相继注册。2023 2024年,RNA碱基编辑与DNA碱基编辑先后用于治疗OTOF点突变致聋小鼠。
目前,已有 8 项 DFNB9 的 AAV 基因治疗临床试验注册:ChiCTR2200063181、NCT05901480、NCT05788536、NCT05821959、CTIS2023-504466-28-00(NCT06370351)、NCT06025032、ChiCTR2400091517、NCT06722170(表1)。值得注意的是,由复旦大学附属眼耳鼻喉科医院开展的 RRG-003 基因治疗药物(临床试验注册号:ChiCTR2200063181)于 2022 年率先启动临床试验。2022 年 12 月,世界首位 HHL 患者在上海接受 RRG-003 基因治疗。该患者在治疗后,听力得到恢复,相关成果于 2023 年 10 月在第三十届欧洲基因与细胞治疗学会年会上正式报告。随后OTOV101N+OTOV101C、DB-OTO、AK-OTOF、SENS-501 等药物也相继证实可改善听力。这些突破性研究标志着耳聋治疗进入新时代,并为其他 HHL 提供范式参考。从基础研究到临床转化,临床试验对于验证治疗干预的安全性和有效性至关重要。
HHL 基因治疗临床试验面临两大主要挑战:(1)内耳解剖结构相对封闭且精细,因此需谨慎选择注射路径,以确保手术可行性、实现给药并最小化内耳损伤;(2)首次人体试验需全面规划策略与执行方案,包括制定严格纳排标准、完善安全性与有效性评估体系,建立长期随访策略。本综述将围绕OTOF相关基因治疗临床试验,重点探讨如何将临床前研究转化为安全有效的临床应用。
HHL基因治疗前沿:聚焦OTOF
腺相关病毒(AAV)因其高效耳蜗转导、基因表达长期稳定且原性低,已成为内耳基因递送的首选载体。成熟耳蜗的 AAV 转导研究尤为关键:成年小鼠中,多种病毒衣壳(AAV1/2/8/9、Anc80L65、AAV-ie、PHP.eB、PHP.S)均可高效转导内毛细胞(inner hair cells,IHCs),而外毛细胞(outer hair cells,OHCs)转导效率不一致。非人灵长类动物(non-human primate,NHPs)研究则呈现更理想的转导谱:3 10 7 10 载体基因组(vg)剂量的 AAV-PHP.B 几乎实现全部毛细胞(HC)感染;4.7 10 5.8 10 vg 的 AAV-S 可在毛细胞、支持细胞及侧壁细胞等多种耳蜗细胞类型中高效表达外源基因。人内耳组织体外实验显示,AAV9-PHP.B 对胎儿 HC 的转导率37%。三种模型中,NHPs 在体转导数据因免疫/代谢同源性高、耳蜗解剖比例与人相近,更具临床参考价值。
AAV 载体并非仅局限于耳蜗亚群转导,非靶组织的异位表达可能诱发毒性。为提高治疗的安全性和精准性,需优化递送策略。有效手段之一是利用细胞类型特异性启动子,实现基因表达的精准。已鉴定的耳蜗特异性启动子包括:毛细胞特异性启动子(Myo7a、Myo15)、外毛细胞特异性启动子(Slc26a5)及支持细胞特异启动子,均可驱动外源基因在耳蜗特定亚型细胞中表达。其中,Myo15启动子可高效、特异性地驱动 GFP 在毛细胞表达,并在Otof突变小鼠中证实治疗效果,已用于三项DFNB9临床试验。由AAV1与 AAV-ie 混合载体递送的支持细胞特异性启动子驱动外源 GJB2 表达,可在Gjb2条件敲除小鼠(Gjb2-cKO)中有效恢复听力,展现出良好的临床转化前景。
目前基因治疗策略涵盖基因替代与基因编辑两大方向。针对 DFNB9,既可递送外源OTOF基因实现替代治疗,也可通过基因编辑直接修正突变位点(图2)。
OTOFcDNA(NM_0012879.2,5994 bp)超出单个 AAV 约 4.7 kb 的包装上限,可在核酸或蛋白水平采用重组策略,以双 AAV 载体形式将大基因递送至靶细胞(图2A)。核酸水平重组包括重叠法、反式剪接法及杂交策略法(hybrid-AK与hybrid-AP)。研究者将OTOF拆分为两个片段,分别包装至两个 AAV 载体后,共同注射Otof / 或OtofQ939*/Q939*小鼠,成功恢复全长otoferlin蛋白表达并重建听觉功能【7,8,37,39,40】(图2B)。内含肽介导的蛋白质剪接是mRNA反式剪接的替代方案,通过融合分裂内含肽催化形成功能性蛋白。采用内含肽剪接的双 AAV-OTOF 系统使Otof / 小鼠恢复至接近野生型小鼠的听力(图2B)。该方法简便、无需外源诱导剂或能量供给,但筛选高效剪接的最佳断裂位点仍面临挑战且耗时费力。目前已启动的DFNB9基因治疗临床试验多采用 hybrid-AK 或 hybrid-AP 策略(图2E)。
鉴于基因替代存在蛋白长期稳定表达不足且缺乏调控手段,研究者进一步探索了针对OTOF点突变耳聋小鼠的基因编辑方案。碱基编辑可分为靶向 RNA 和靶向 DNA 两大类别:薛等人采用微型化 RNA 编辑器 emxABE 治疗人源化OtofQ829X/Q829X小鼠,使听觉功能恢复至野生型水平,并维持至少7个月(图2C);崔等人开发 ABE 治疗系统,纠正致病突变后,OtofQ828X/Q828X小鼠听觉功稳定恢复至接近野生型水平,观察超过 1.5 年仍维持疗效(图2D)。基因编辑技术通过精准编辑特定位点为个体化治疗提供巨大潜力,但仍面临脱靶效应及编辑效率不一致等挑战。
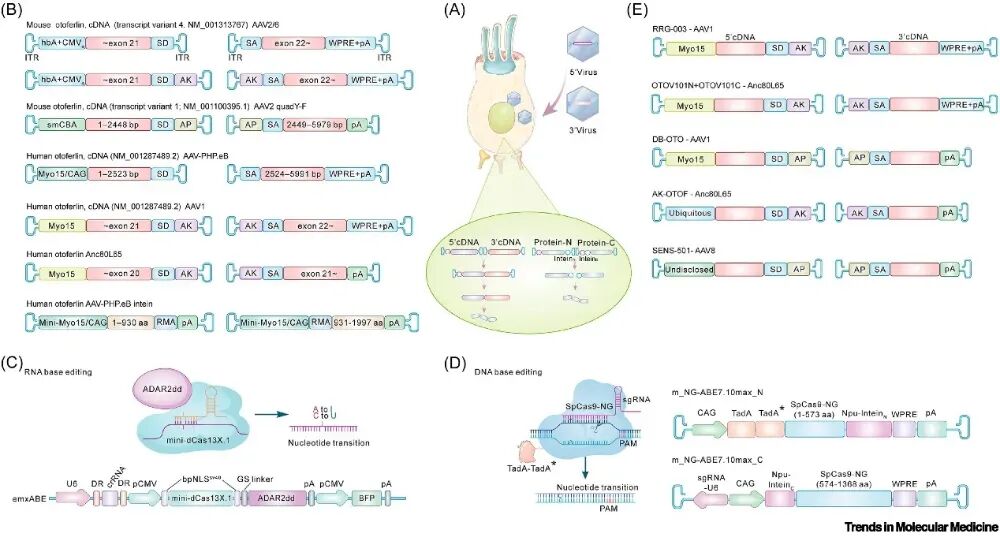
图2. DFNB9基因治疗策略
(A)DFNB9基因治疗示意图:两种携带5 与3 基因片段的AAV递送至内毛细胞,片段经核酸重组或蛋白重组拼接成完整功能基因或蛋白。核酸重组利用同源序列与剪接位点精确连接;蛋白重组依赖内含肽介导的翻译后剪接,无缝连接两个蛋白片段,从而形成完整的功能蛋白。(B)在OTOF突变小鼠模型中应用基因替代技术:涉及cDNA转录本、AAV血清型、启动子、分割位点及治疗策略。(C)RNA碱基编辑:失活dCas13X.1与ADAR2dd融合,经crRNA靶向结合,将A I或C U,实现精确RNA编辑。(D)DNA碱基编辑:SpCas9-NG(切口酶)与ABE7.10max融合,将A G以校正基因突变。(E)五种DFNB9临床基因治疗方案涵盖所用AAV血清型、启动子与治疗策略。
内耳递送:人体转化
内耳由骨迷路和膜迷路组成。两者之间充满富含钠离子的外淋巴液,膜迷路内则含富含钾离子的内淋巴液,这两种液体分别类似于细胞外液和细胞内液。这两种淋巴液互不相通,对维持听觉和前庭功能所需的离子梯度至关重要。在新生小鼠、成年小鼠和非人灵长类模型上,验证了多种AAV内耳注射路径:圆窗膜(round window membrane,RWM)、镫骨底板/卵圆窗(stapedotomy/oval window,OW)、半规管(semicircular canal,SCC)、中阶注射、RWM+SCC 或 RWM+OW 联合、椭圆囊及经枕大池脑脊液(图3A)。
临床患者内耳给药面临挑战之一在于确定治疗剂量。由于内耳大小不随年龄增长发生显著变化,可采用固定剂量(vg/例)确定给药方案。人颞骨标本研究显示:在人类颞骨中,两种独立方法测得的内耳迷路液总体积结果高度一致:水平连续切片法为 204.5 L(内淋巴38.1 L;外淋巴166.4 L),模具法为 192.5 L(内淋巴34.0 L;外淋巴158.5 L);三维 MRI 测得耳蜗液体容量为 51.4 L(鼓阶29.22 L;前庭阶+内淋巴22.18 L)。
首个耳聋基因治疗药物 CGF166(NCT02132130)设计剂量 20 L 或 60 L。当前 DFNB9 临床试验采用不同治疗体系,单耳给药体积分别为 30 L(9 1011vg)、30 40 L(8.4 1011 1.12 1012vg)、50 L(1.5 1012vg)及240 L(7.2 1012vg)。这些注射体积的差异,可能源于内耳亚结构(如耳蜗、鼓阶、外淋巴容积)的不同考量。
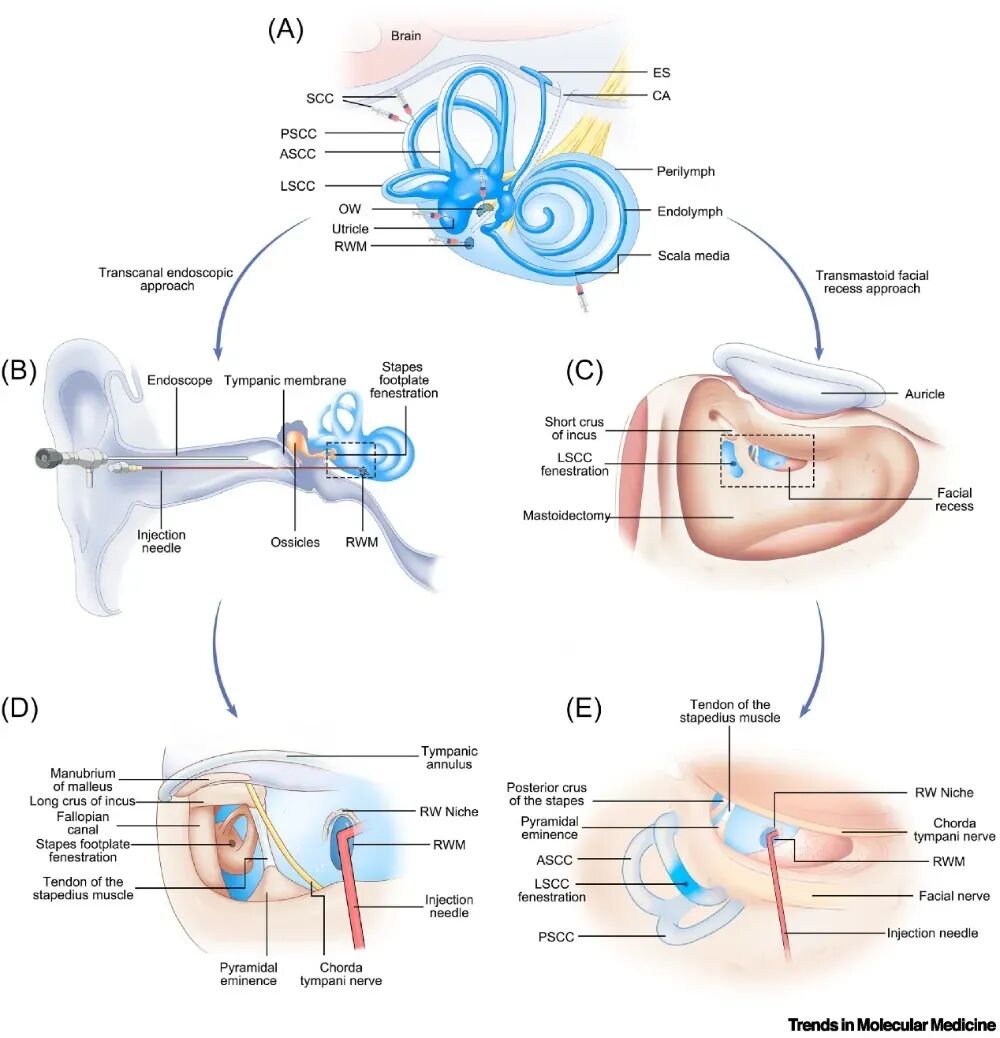
图3. 内耳递送途径
(A)内耳注射位点示意:外淋巴(浅蓝)与内淋巴(深蓝)分隔。外淋巴经蜗水管(CA)与脑脊液相通,内淋巴相对封闭。常见动物注射途径:RWM注射、SCC注射、椭圆囊注射、蜗管中阶注射、OW注射;亦可行RWM注射+OW开窗或RWM注射+SCC开窗。(B),(D)经外耳道入路。(B)整体图:翻起外耳道皮瓣,在耳内镜直视下注射。(D)局部图:外耳道后上壁切除以显露后鼓室与镫骨底板;磨除圆窗龛以暴露圆窗膜实施注射,并对镫骨底板/卵圆窗开窗。(C),(E)经乳突面隐窝入路[89]。(C)整体图:乳突轮廓化,打开面隐窝暴露圆窗,镫骨底板未显露。(E)局部图:磨除圆窗龛暴露圆窗膜注射,并选择性LSCC开窗。缩写:ASCC,前半规管;PSCC,后半规管;LSCC,外侧半规管;ES,内淋巴囊;VA,前庭导水管。
临床递送的另一关键是注射路径的选择。Staecker 等人开创的镫骨底板/卵圆窗注射最早应用于人体,治疗重度至极重度听力损失的患者。在基因治疗HHL患者的RWM注射(联合或不联合其他内耳操作)中,采用两种手术入路:①外耳道入路(外耳道皮瓣,图3B,D)。②乳突面隐窝入路(类似人工耳蜗,图3C,E)。经耳道路径外耳道皮瓣翻瓣后,行外耳道后上壁切除,见镫骨足板与圆窗龛;镫骨足板(OW)开窗的操作可在RWM注射时促进淋巴液流动、降低鼓阶及前庭阶内的压力,降低压力损伤风险,并可能减少药物经耳蜗导水管进入中枢的传播(尽管有报道人耳蜗导水管可能闭塞)。经乳突面隐窝入路,类似于人工耳蜗植入术,是耳鼻喉科医生熟悉的方法。此方法可暴露外半规管以便进行选择性半规管开窗。理论上,经外耳道入路组织损伤最小,避免了乳突损伤,并缩短了手术时间,目前此入路在临床试验中已在耳内镜辅助下进行,在某些病例中外耳道入路也可使用显微镜完成。外科医生的经验以及圆窗龛的定位(例如通过高分辨率CT),有助于选择合适的手术可视化设备,例如耳内镜、显微镜、双镜联合、或 4K-3D 外视镜等设备。在有限操作空间下,建议使用特殊设计的角度微注射装置以实现精准穿刺圆窗膜。
临床实践中仍存在若干挑战:在耳内镜手术中,针对儿童耳道狭窄的特点,需开发小直径、大视角的内镜设备(包括变焦内镜),以改善手术视野;对注射针的长度、刚性与角度进行优化,并结合局部固定技术,可提升手术操作的精确性和稳定性;简化注射泵的设计将使操作更直观,便于外科医生更好地控制药物注射过程;术后注射位点的封闭策略旨在维持治疗药物在内耳的有效浓度,同时不影响双窗的活动,这是一个重要但尚未深入研究的领域;鉴于内耳手术的复杂性,建立标准化的手术培训项目有助于提高手术成功率,降低内耳并发症风险,并确保最佳治疗效果。
DFNB9基因治疗临床试验
DFNB9 基因治疗临床试验已有 8 项注册,其中 7 项(除NCT06025032)已对患者进行药物治疗。有 5 项临床试验通过发表论文或学术会议报告治疗效果。候选药物按照首次人体(first-in-human)用药日期的先后顺序列出如下:RRG-003、OTOV101N+OTOV101C、DB-OTO、AK-OTOF、SENS-501。
RRG-003 于 2022 年 12 月完成全球首例先天性听力损失患者的单侧治疗,2023 年 7 月首例双侧治疗,详细信息见下表。
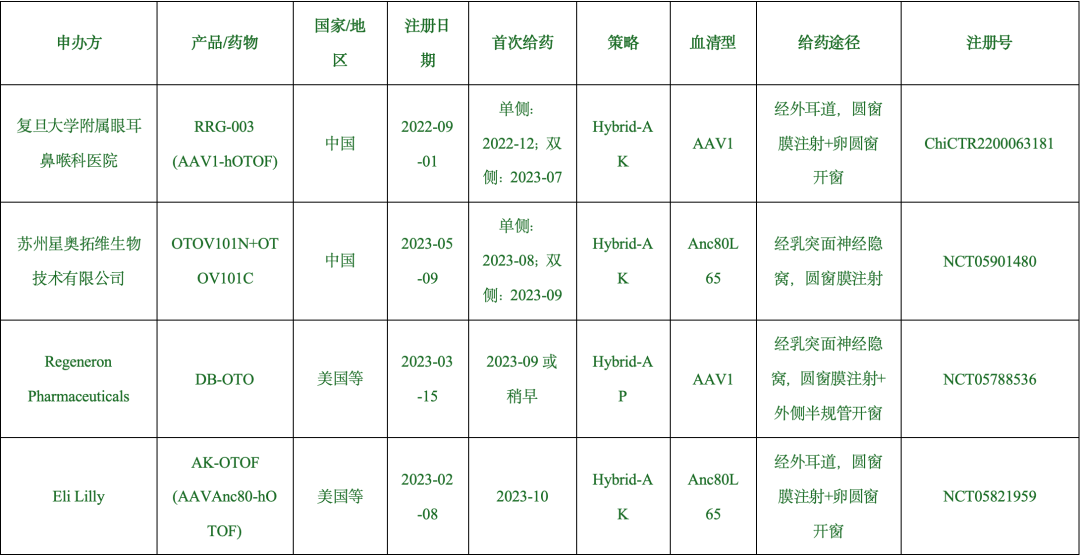
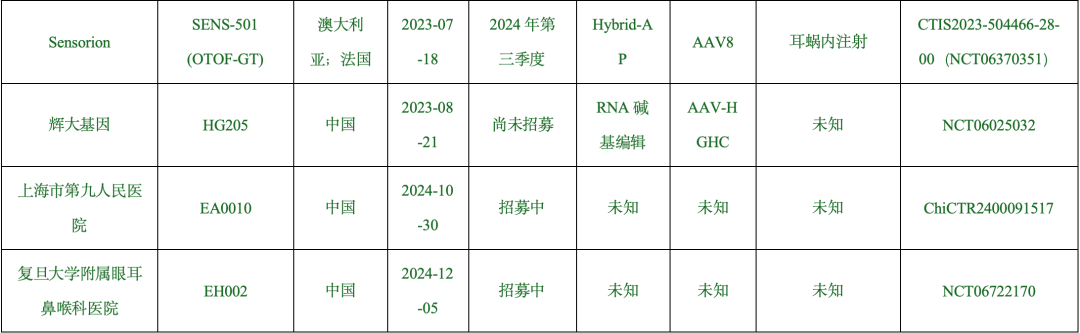
表1. DFNB9基因治疗的临床试验
备注:数据来源于临床试验注册平台(https://trialsearch.who.int)、已发表论文、国际学术会议报告及官方媒体。临床试验排序按首例治疗日期。
治疗前入组
5 项干预性试验主要采用非随机分配,多为单臂或序贯分配,入组标准为携带OTOF双等位基因致病性/可能致病性突变的重度至全聋患者。各研究设计的纳入标准差异如下:(1)中和抗体(Neutralizing antibodies,NAbs):RRG-003 与 OTOV101N+OTOV101C 初期限定 AAV 中和抗体滴度,RRG-003 已取消此限制;(2)年龄:RRG-003 纳入年龄初始为 1 18 岁,调整为 6 月龄;OTOV101N+OTOV101C 纳入年龄初始为 3 岁,调整至 1 岁;AK-OTOF 纳入年龄初始为 2 17 岁,放宽至各年龄。DB-OTO 聚焦 18 岁患者;SENS-501 设定 6 31 月龄患者;(3)治疗体系:血清型 AAV1(RRG-003,DB-OTO)、Anc80L65(OTOV101N+OTOV101C,AK-OTOF)、AAV8(SENS-501);特异性启动子Myo15(RRG-003,OTOV101N+OTOV101C,DB-OTO)或泛启动子(AK-OTOF);重组方式:AK(RRG-003,OTOV101N+OTOV101C,AK-OTOF)、AP(DB-OTO,SENS-501);(4)给药路径:RRG-003、AK-OTOF 采用内镜下经耳道 RWM注射+OW开窗;OTOV101N+OTOV101C 采用显微下经乳突面隐窝RWM注射;DB-OTO 采用经乳突面隐窝 RWM 注射+外半规管开窗。
在不同治疗领域,为规避预先存在的 AAV 中和抗体的影响而排除患者的比例差异显著。研究表明,人体中对 AAV1、AAV2、AAV7、AAV8 等血清型的中和抗体阳性率较高(AAV2可达30 70%)。在血液系统疾病的 AAV 基因治疗临床试验中,约 90% 会排除中和抗体阳性受试者;相比之下,眼科试验排除比例不足 10%,系统试验约为21%。这一差异可能与血-视网膜屏障和血 脑屏障提供的免疫豁免有关。鉴于耳蜗同样存在血 迷路屏障,也被视为免疫豁免器官,未来研究或许可以证实无需基于中和抗体滴度排除患者。
排除标准通常包括:耳部解剖异常、其他耳疾病(中耳炎、梅尼埃病等)、双侧人工耳蜗植入、严重系统性疾病(如心疾病、、感染、免疫缺陷等)、无法耐受麻醉/手术、近期使用耳毒性药物、参加其他临床试验或既往基因治疗史;育龄期女性需有效避孕且非妊娠/哺乳。
治疗后评估
AAV 基因治疗临床试验治疗后评估包括早期疗效、安全评估、长期随访,目前尚缺乏国际统一的疗效评估标准。首次人体试验首要目标为安全性,需严密监测治疗相关的不良事件(treatment-emergent adverse events,TEAE)的发生率与严重程度。完善的试验设计应包含全面安全性评估、详细疗效评价和结构化随访方案,以全面评估治疗风险与获益情况。
安全性评估
在 HHL 的临床前研究中,首先对听觉功能、行为/记忆与耳蜗组织病理学评估以确保基因治疗药物的安全性,继而检测病毒体内分布及脱落以评估非靶器官的病毒转导。内耳 AAV 递送:耳蜗内载体基因组浓度高,靶外组织低;中枢神经系统及脑、肝、脾、淋巴结仍可出现靶外转导。非人灵长类研究中,载体在血清、尿液、泪液、粪便、唾液和鼻分泌物中 4 周内快速清除,耳部分泌物 4 个月后无阳性样本,这些结果为推进临床试验提供了支持。
在 5 项临床试验中,均未观察到剂量限制性毒性或药物相关严重不良事件(serious adverse events,SAE)。RRG-003:11 例共 84 个不良事件(adverse events,AE),82 个为 1 2 级(多见淋巴细胞升高、乳酸脱氢酶升高等),2 个 3 级为短暂中性粒细胞减少。OTOV101N+OTOV101C:10 例 162 个 AE,均为 1 2 级(中性粒比例下降、血小板升高、轻度)。DB-OTO:10 例 53 个 AE;12 名受试者中 5 名出现短暂前庭症状(眼震、恶心、眩晕、呕吐),后缓解;2 个严重不良事件:一例 10 月龄双侧乳突炎(后恢复),另一例步态不稳 24 小时内恢复。AK-OTOF 与 SENS-501 暂未见SAE。整体显示内耳局部 AAV 递送治疗体系的安全性良好。
在临床应用中,显著的 AE 包括免疫介导的肝毒性和性微、AAV 转导引起的背根神经节毒性,以及系统性与局部炎症。在高剂量( 5 1013vg/kg)全身给药的 AAV 基因治疗试验中,可能出现载体相关不良事件(AE)。为减轻免疫反应,患者通常接受糖皮质激素或其他免疫抑制剂治疗。在 HHL 基因治疗中,因局部注射使所需剂量显著降低,加之内耳的免疫豁免特性,其免疫原性可能较低。目前,AE 报告随访观察期多在 12 个月内,随着随访期延长,正在进行的临床试验有望产生更多长期安全性数据。此外,针对 B 型采用 scAAV2/8-LP1-hFIXco(2 1011-2 1012vg/kg,随访中位数13.0年)的最新长期安全性报告显示未发现安全性问题[76]。推测DFNB9基因治疗在长期监测中亦可能具有良好安全性。在整个安全性监测过程中,尤其是首次人体(first-in-human)试验阶段,实施围手术期糖皮质激素用药,对生命体征、体格检查及主要器官功能进行全面评估,以确保治疗安全。
疗效评估
耳聋基因治疗的疗效核心指标为听觉功能的改善,因此围手术期听力学评估至关重要。客观听力检测包括用于评估中耳压力的声导抗、评估外毛细胞功能的畸变产物耳声发射(distortion product otoacoustic emission,DPOAE)、用于确定不同频率客观听阈的听性脑干反应(auditory brainstem response,ABR)与听觉稳态反应(auditory steady-state response,ASSR)。主观评估按年龄阶段实施。0 6 月龄采用行为观察测听(behavioral observation audiometry,BOA,仅作定性参考)。6 36 月龄采用视觉强化测听(visual reinforcement audiometry,VRA)或条件游戏测听(conditioned play audiometry,CPA)并结合言语测听。对于 3 5 岁的儿童,VRA 和 CPA 仍然适用,同时还可辅以系统的言语测听识别。对于已具备交流能力或语言基础的大龄儿童与成人,标准的纯音测听为主要的评估工具。
临床试验结果显示听力均获改善,但随访时间和听力提升程度各异。RRG-003:共 11 例(单侧6例,年龄1.0 6.2岁;双侧5例,年龄1.2 11岁)。第一例患者于 2022 年 12 月接受治疗。单侧受试者中 5/6 在 26 周时 0.5 4 kHz 平均 ABR 阈达到 38 55 dB HL;双侧 5 例于 13 周时 ABR 阈改善至 58 88 dB HL,26 周时其中 3 例进一步改善至 50-85 dB HL。OTOV101N + OTOV101C:10 例(单侧7例,双侧3例,年龄1.5 23.9岁),第一例患者于 2023 年 8 月接受治疗。全部听力改善;其中 23.9 岁受试者治疗后 9 个月平均 tone-burst ABR 63 dB HL,提示成人同样可获益。DB-OTO:12 例(单侧9例,双侧3例,年龄10月龄 16岁),推测第一例患者于 2023 年 9 月或在此之前接受治疗。其中 10 例判定为有效。最小年龄(10月龄)受试者 24 周时 1 4 kHz ABR 改善至 65 85 dB HL,48 周继续改善;随访超过 24 周的 5 例中,3 例阈值 40 dB HL,2 例 25 dB HL。AK-OTOF:首例 11 岁患儿在 2023 年 10 月接受治疗,由极重度提升至 65 20 dB HL;另一 8 岁患儿行为听阈也有改善。SENS-501:3 名患儿,首例治疗后 1 个月即出现行为及发声反应。总体而言,多数患者在 1 个月内出现听觉改善,部分更早。
听觉为言语发展所必需,它为语言习得与交流能力提供必要的声音输入与自我反馈。言语功能的改善通常通过问卷与测试加以评估,幼龄儿童多依赖家长或监护人提供信息。常用评估工具包括:婴幼儿有意义听觉整合量表(Infant-Toddler Meaningful Auditory Integration Scale,IT-MAIS)、有意义听觉整合量表(Meaningful Auditory Integration Scale,MAIS)、有意义言语使用量表(Meaningful Use of Speech Scale,MUSS)、听觉表现分级(Categories of Auditory Performance,CAP)、言语可懂度分级(Speech Intelligibility Rating,SIR)以及言语空间听觉质量量表-父母版(Speech, Spatial, and Qualities of Hearing Scale for Parents,SSQ-P)。对于较大儿童与成人,则在安静与噪声环境下开展言语测听,包括言语听阈测试、词表识别测试及噪声中言语识别测试等。此外,还可采用如 SSQ 等自评工具衡量患者主观听觉感知。在 5 例单侧与 5 例双侧患者中,通过 IT-MAIS 或 MAIS、CAP 及 MUSS 评估,均观察到听觉与言语感知的显著改善;并且 5 例双侧患者的 SSQ-P 评分明显提升,同时其声源定位能力得到恢复。
全面的疗效评估还应考虑心理状态、认知、学习与社会适应,然而,这些评估在很大程度上依赖于患者或监护人的主观反馈,可能会存在一定偏倚。并且此类评估工具通常基于特定语言与文化背景,这可能会限制其在不同人群中的适用性与准确性。功能性近红外光谱成像(functional near-infrared spectroscopy,fNIRS)、脑电图(electroencephalography,EEG)及功能性磁共振成像(functional magnetic resonance imaging,fMRI)等先进技术,能够客观揭示脑功能以及听力恢复的神经动态过程。尽管这些方法可提供有价值的数据,其高成本与技术复杂性限制了其在常规临床中的普遍应用。
随访
首例接受 RRG-003 基因治疗的 DFNB9 患者在治疗后 24 个月内听力稳定(具体数据尚未公开),然而内耳基因治疗目前仍缺乏统一的随访规范。我们可借鉴眼科基因治疗的经验。例如,在 Leber 先天性黑朦基因治疗的评估中,报道的观察时间点包括注射后 6 个月、9 个月、1 年、1.5 年、2 年、3 年及 5 年。这些随访时间点是经过策略性设定的,旨在支持对治疗疗效的持续评估以及对副作用的长期监测。随访方案应明确评估的时间间隔、总观察期及其检测内容,包括听力学评估、生物标志物分析与患者报告结局(PRO)。建立一套严格的随访框架将确保对AAV基因治疗的长期获益与潜在风险进行全面评估。
结语
在 AAV 介导的 HHL 基因治疗领域,已有超过 60 项研究在小鼠模型中针对约 20 个致聋基因开展探索。DFNB9 患者基因治疗的成功基于三个关键因素:首先,对OTOF基因的生物学机制已有充分认识,其突变通常不引起细胞的死亡或解剖结构的破坏;其次,应用于内耳的 AAV 载体能够高效转导内毛细胞,与 otoferlin 蛋白在内毛细胞的定位高度一致;更重要的是,充分的临床前研究的治疗效果与安全性证据为顺利的临床转化铺平了道路。尽管如此,仍有若干挑战亟待探索。
为治疗更多 DFNB9 患者,需明确合适的受试人群并确定最佳干预时机,特别要综合考虑年龄与听力损失程度。关于年龄,目前已在青年期人群中证实疗效,但药物在中老年候选者中的有效性仍不确定。随年龄增长,20% 80% 的个体出现 OAE 下降或消失,提示部分或全频段的声放大功能减弱。动物研究也显示,DPOAE 异常可能限制基因治疗疗效,这一现象或可延伸至患者。DPOAE 尤其在成人中可能会作为疗效评估的预测指标之一。关于听力损失程度,当前治疗多聚焦于重度至极重度、完全听力损失人群,部分患者在治疗后纯音阈接近正常。治疗获益最终取决于药物本身的效力与注射过程对残余听力潜在损害的权衡。人类内耳注射对残余听力的具体影响仍不明确,因其涉及淋巴液容量与离子稳态调控,以及微环境扰动引发的病理生理反应。深入研究内耳注射后的病理生理机制对保护功能性残余听力至关重要,但现有研究仍显不足。与残余听力相关的基因(TMPRSS3、KCNQ4、STRC)构成值得优先关注的潜在干预靶点。除此之外,对于尚未明确致病突变的患者,可通过制定相应的治疗策略并结合动物模型的功能验证来鉴别潜在致病位点。
HHL 基因治疗的临床转化过程中引发了新的科学问题与挑战。在儿童人群中,优化治疗后的言语康复策略与阐明听觉及语言发育机制是提升临床结局的关键。对初始治疗效果有限的患者,需要探索再次治疗策略(包括时间与治疗方案)。此外,将基因治疗与传统人工耳蜗的治疗结果进行比较,有助于为不同患者群体筛选最适宜的治疗方法。对于如 Usher 综合征等伴发听觉、视觉乃至前庭的综合征型听力损失,目前包括基因替代、细胞治疗等多种策略正在临床前与临床研究中推进。针对MYO7A与USH2A的动物模型试验已在改善前庭或视觉功能方面已出现疗效,但听力恢复仍有挑战,需在递送方式、时机与靶向特异性方面继续优化。
DFNB9 临床试验设计正基于前期结果的科学验证不断迭代。借鉴多项试验经验,可进一步完善受试者入选标准、安全监测指标、疗效评估体系与随访方案。为提高数据的可靠性,试验设计可拓展为多中心、国际化研究,覆盖更广泛人群。同时,临床试验也应致力于研究方法与操作流程的规范化,推动治疗标准与评价框架的建立。
DFNB9 基因治疗实现成功的临床转化,为其他类型HHL的基因治疗药物开发提供了关键经验与可复制的路线蓝图。在创新技术持续演进、领域关注度不断提升及其对患者获益的共同推动下,听觉基因治疗预计将进入加速发展阶段,使患者得以逐步从寂静世界迈向有声世界。这一变革性进展不仅实现听力功能的恢复,还促进患者社会交互与的提升,并为听觉医疗治疗体系的转型提供契机。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 加科思药业就非肿瘤资产与海松资本达成战略交易 聚焦核心创新管线 (2025-10-16)
- Cell:遗传变异可导致复杂疾病的不同临床特征 (2025-10-16)
- 国度医保局曝光5起骗取生养保险基金典型案例 (2025-10-16)
- 天气转凉这些沾染病多发!防护攻略看这里 (2025-10-16)
- AD:肠炎阻碍大脑“排毒”!研究发现,肠道炎症通过扰乱昼夜节律,损害大脑类淋巴系统排污能力,为神经退行性疾病的发生埋下伏笔 (2025-10-16)
- 解决胰岛素百年困境!David Baker团队从头设计出更安全有效的“AI胰岛素”,开启糖尿病治疗新时代 (2025-10-16)
- Cell Stem Cell:刘光慧团队等首次证实,维生素C可延缓灵长类卵巢衰老 (2025-10-16)
- 《自然·遗传学》:难怪食管癌那么凶狠!中国科学家首次发现一种周细胞,不仅能促进食管癌转移,还能打造免疫抑制微环境 (2025-10-16)
- 《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈 (2025-10-15)
- 闻一口就知道爱不爱?《细胞》研究揭脑内机制:侧角区神经元当“裁判”,两套逻辑判香臭 (2025-10-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















